题目内容
14.下列物质的熔点高低顺序,正确的是( )| A. | 金刚石>晶体桂>碳化硅 | B. | Na>Mg>Al | ||
| C. | NaF<NaCl<NaBr | D. | CI4>CBr4>CCl4>CH4 |
分析 A.原子晶体的组成元素的原子半径越小,键能越大,熔沸点越高;
B、金属键越大金属晶体的熔点越高;
C.离子晶体中离子半径越小,电荷越大,熔点越大;
D、结构相似的分子晶体分子量越大熔点越高.
解答 解:A.原子晶体的组成元素的原子半径越小,键能越大,熔沸点越高,则应有金刚石>碳化硅>晶体硅,故A错误;
B、金属键越大金属晶体的熔点越高,金属键:Na<Mg<Al,所以熔点:Na<Mg<Al,故B错误;
C.因离子半径F-<Cl-<Br-,则熔点为NaF>NaCl>NaBr,故C错误;
D、结构相似的分子晶体分子量越大,分子间作用力越强,则熔点越高,所以熔点高低顺序为CI4>CBr4>CCl4>CH4,故D正确;
故选D.
点评 本题考查晶体的熔沸点的比较,题目难度中等,本题注意判断晶体的类型以及影响晶体熔沸点高低的因素,学习中注意相关知识的积累.

练习册系列答案
相关题目
4.25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.1000mol/L的两种酸HX、HY(忽略滴定前后体积变化),实验数据如表所示,下列判断不正确的是( )
| 实验编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | m |
| ② | 10.00 | x | y |
| ③ | 20.00 | n | 7 |
| A. | 相同温度下.同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 表中x<7 | |
| C. | HX和HY的混合溶液中存在:c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 实验②NaOH与HY反应后的溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
5.25℃时,下列溶液中各离子的浓度关系正确的是( )
| A. | 等物质的量浓度的NH4Cl溶液与(NH4)2SO4溶液相比,前者的c(H+)更小 | |
| B. | 0.1 mol•L-l的CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)>0.1 mol•L-1 | |
| C. | pH=9.4,浓度均为0.l mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将少量AgCl分别加入等体积等物质的量浓度的NaBr溶液与KI溶液中,充分反应后,后者的c(Ag+)更大 |
7.已知:①C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
④C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
下列说法正确的是( )
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
④C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
下列说法正确的是( )
| A. | 将2.4g炭完全转化为水煤气,然后再充分燃烧,整个过程放出热量39.35kJ | |
| B. | C的燃烧热为-110.5kJ/mol | |
| C. | H2的燃烧热为-241.8kJ/mol | |
| D. | 由反应③可知,反应过程中转移5mol电子且生成液态水时放出的热量大于604.5kJ |
8.科技改变生活,充电宝已逐渐成为人们生活中的必需品.某充电宝工作时的总反应式为:V2O3+xLi $?_{充电}^{放电}$ Li4V2O3,下列说法正确的是( )
| A. | 放电时正极上的电极反应为:Li-e-═Li+ | |
| B. | 该充电宝的凝胶介质可用KOH水溶液代替 | |
| C. | 充电时每生成14g Li,凝胶介质中有2mol电子通过 | |
| D. | 充电时电池的正极失电子后Li4V2O3会转化为V2O3 |
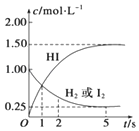 698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:
698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题: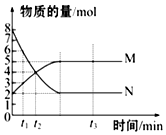 一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: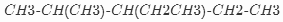 的名称是2-甲基-3-乙基戊烷.
的名称是2-甲基-3-乙基戊烷. .
.