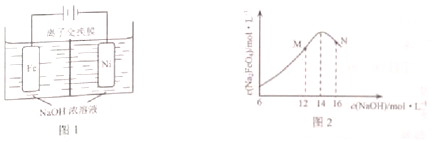
题目内容
6.按要求回答下列问题(1)根据系统命名法,
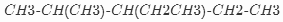 的名称是2-甲基-3-乙基戊烷.
的名称是2-甲基-3-乙基戊烷.(2)羟基的电子式是
 .
.(3)相对分子质量为72且沸点最低的烷烃的结构简式是CH3C(CH3)2CH3.
分析 (1)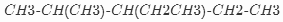 为烷烃,主链有5个碳原子,从左端编号,2号碳上有1个甲基,3号碳上有1个乙基,据此书写名称;
为烷烃,主链有5个碳原子,从左端编号,2号碳上有1个甲基,3号碳上有1个乙基,据此书写名称;
(2)羟基由一个氧原子和一个氢原子构成,氧原子最外层6个电子,氢原子最外层一个电子,二者形成一个共用电子对;
(3)设烷烃的分子式为CxH(2x+2),根据相对分子质量为72,列出方程式进行计算x值,支链越多,沸点越低.
解答 解:(1)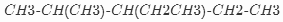 为烷烃,主链有5个碳原子,从左端编号,2号碳上有1个甲基,3号碳上有1个乙基,据其系统命名为:2-甲基-3-乙基戊烷;
为烷烃,主链有5个碳原子,从左端编号,2号碳上有1个甲基,3号碳上有1个乙基,据其系统命名为:2-甲基-3-乙基戊烷;
故答案为:2-甲基-3-乙基戊烷;
(2)从羟基的中心原子O周围7个电子,羟基中存在一对共用电子对,羟基的电子式为 ,
,
故答案为: ;
;
(3)设烷烃的分子式为CxH(2x+2),
则14x+2=72,解得x=5,所以该烷烃的分子式为C5H12,分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的:CH3CH(CH3)CH2CH3,
主链有3个碳原子的:CH3C(CH3)2CH3;
支链越多,沸点越低,故CH3C(CH3)2CH3,
故答案为:CH3C(CH3)2CH3.
点评 本题考查了等电子式、有机化合物的命名,题目难中等,注意掌握常见化学用语的表示方法,把握有机物的官能团的性质以及相关结构简式的书写方法,掌握有机物的命名原则是解题关键.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
16.中和滴定中用已知浓度的稀盐酸滴定未知浓度的稀氨水,计算式与滴定氢氧化钠溶液类似:c1V1=c2V2,则( )
| A. | 终点溶液偏碱性 | B. | 终点溶液中c(NH4+)=c(Cl-) | ||
| C. | 终点溶液中氨过量 | D. | 合适的指示剂是甲基橙而非酚酞 |
17.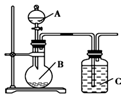 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )| A. | 稀H2SO4 | B. | Na2SO4溶液 | C. | Na2CO3溶液 | D. | Na2SiO3溶液 |
14.下列物质的熔点高低顺序,正确的是( )
| A. | 金刚石>晶体桂>碳化硅 | B. | Na>Mg>Al | ||
| C. | NaF<NaCl<NaBr | D. | CI4>CBr4>CCl4>CH4 |
1.结构为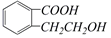 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:
①
②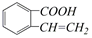
③
④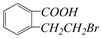
生成这四种有机物的反应类型依次为( )
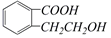 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:①

②

③

④
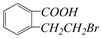
生成这四种有机物的反应类型依次为( )
| A. | 取代、消去、酯化、加成 | B. | 取代、消去、加聚、取代 | ||
| C. | 酯化、取代、缩聚、取代 | D. | 酯化、消去、氧化、取代 |
11.下列说法不正确的是( )
| A. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相同 | |
| B. | 非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 | |
| C. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 | |
| D. | 将CO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 |
2.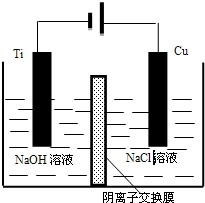 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如表所示.
下列叙述正确的是cd(填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如表所示.
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
20.下列实验能达到目的是( )
| A. | 用KI溶液除去FeCl2溶液中的Fe3+ | B. | 用饱和NaHCO3溶液除去Cl2中的HC1 | ||
| C. | 用金属钠鉴别1一丁醇和2一丁醇 | D. | 用溴水鉴别苯和己烯 |