题目内容
2.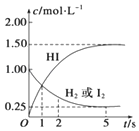 698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:
698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:(1)容器的体积V=3L.
(2)反应达到最大限度的时间是5s,该时间内平均反应速率v(HI)=0.5mol/(L•s).
分析 (1)根据V=$\frac{n}{c}$计算;
(2)当反应达到平衡状态时,各物质的浓度不变,根据v(HI)=$\frac{△c}{△t}$计算.
解答 解:(1)根据图象知,氢气和碘初始物质的量浓度为1mol/L,所以容器的体积=$\frac{3mol}{1mol/L}$=3L,
故答案为:3;
(2)当反应达到平衡状态时,各物质的浓度不变,根据图象知,当反应物和生成物浓度不变时,时间为5s,v(HI)=$\frac{1.5mol/L}{5s}$=0.5mol/(L•s).
故答案为:5;0.5mol/(L•s).
点评 本题考查化学平衡计算、平衡状态判断、反应速率计算,为高频考点,侧重考查学生的分析能力和计算能力,难度不大,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

练习册系列答案
相关题目
12.X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期.下列说法正确的是( )
| A. | 简单离子半径R>W>Y>Z | |
| B. | 气态氢化物稳定性:HmW<HnR | |
| C. | Z2Y2电子式可表示为  | |
| D. | RY2和W2均有漂白性,将两者等物质的量混合溶于水,漂白性增强 |
13.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
| A. | 标准状况下,11.2L CH2C12含极性共价键数目为2NA | |
| B. | 含1 mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+的数目大于NA | |
| C. | 4.6g甲苯(C7H8)和丙三醇(C3H8O3)混合物中含H原子数目为0.4NA | |
| D. | 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA |
10.下列离子方程式正确的是( )
| A. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属钠投入MgCl2溶液中:2Na+Mg2+═2Na++Mg | |
| C. | 0.1mol/LNaHSO4溶液与0.1mol/LBa(OH)2溶液等体积混合:SO42-+Ba2+=BaSO4↓ | |
| D. | 硅酸钠水溶液中通入过量CO2:SiO32-+2H2O+2CO2═2HCO3-+H2SiO3↓ |
17.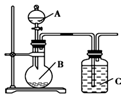 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )| A. | 稀H2SO4 | B. | Na2SO4溶液 | C. | Na2CO3溶液 | D. | Na2SiO3溶液 |
7.能用于鉴别CO2 和SO2 的试剂是( )
| A. | 硝酸钡溶液 | B. | 澄清石灰水 | C. | 紫色石蕊试液 | D. | 氯化钡溶液 |
14.下列物质的熔点高低顺序,正确的是( )
| A. | 金刚石>晶体桂>碳化硅 | B. | Na>Mg>Al | ||
| C. | NaF<NaCl<NaBr | D. | CI4>CBr4>CCl4>CH4 |
11.下列说法不正确的是( )
| A. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相同 | |
| B. | 非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 | |
| C. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 | |
| D. | 将CO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 |
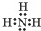 .
.