题目内容
5.25℃时,下列溶液中各离子的浓度关系正确的是( )| A. | 等物质的量浓度的NH4Cl溶液与(NH4)2SO4溶液相比,前者的c(H+)更小 | |
| B. | 0.1 mol•L-l的CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)>0.1 mol•L-1 | |
| C. | pH=9.4,浓度均为0.l mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将少量AgCl分别加入等体积等物质的量浓度的NaBr溶液与KI溶液中,充分反应后,后者的c(Ag+)更大 |
分析 A.NH4Cl溶液与(NH4)2SO4溶液中铵根离子水解程度相同,但水解的个数前者小于后者;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.浓度均为0.l mol•L-1的HCN与NaCN的混合溶液中,pH=9.4,溶液呈碱性,说明NaCN水解程度大于HCN电离程度;
D.溶解度:AgCl>AgBr>AgI,溶解度小的物质溶液中c(Ag+)小.
解答 解:A.NH4Cl溶液与(NH4)2SO4溶液中铵根离子水解程度相同,但水解的个数前者小于后者,所以等物质的量浓度的NH4Cl溶液与(NH4)2SO4溶液相比,前者的c(H+)更小,故A正确;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.1mol•L-1,故B错误;
C.浓度均为0.1mol•L-1的HCN与NaCN的混合溶液pH=9.4>7,说明溶液呈碱性,则HCN电离程度小于CN-水解程度,但HCN电离、NaCN水解程度都较小,则溶液中存在c(HCN)>c(Na+)>c(CN-)>c(OH-),故C错误;
D.溶解度小的物质溶液中c(Ag+)小,溶解度:AgCl>AgBr>AgI,所以后者的c(Ag+)更小,故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确溶液中溶质及其性质是解本题关键,注意C中电离程度和水解程度相对大小,为易错点.

练习册系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | F2与NaOH溶液反应:F2+4OH-═2F-+O2+2H2O | |
| C. | AgNO3溶液中加入少量氨水:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
16.中和滴定中用已知浓度的稀盐酸滴定未知浓度的稀氨水,计算式与滴定氢氧化钠溶液类似:c1V1=c2V2,则( )
| A. | 终点溶液偏碱性 | B. | 终点溶液中c(NH4+)=c(Cl-) | ||
| C. | 终点溶液中氨过量 | D. | 合适的指示剂是甲基橙而非酚酞 |
13.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
| A. | 标准状况下,11.2L CH2C12含极性共价键数目为2NA | |
| B. | 含1 mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+的数目大于NA | |
| C. | 4.6g甲苯(C7H8)和丙三醇(C3H8O3)混合物中含H原子数目为0.4NA | |
| D. | 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA |
20.对下列选项中的操作和现象,其解释与结论完全正确的是( )
| 选项 | 操作 | 现象 | 解释与结论 |
| A | 室温下,向浓度均为0.1mol•L-1的KCl和KI混合溶液中滴加AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 无水乙醇与浓硫酸共热至170℃,将产生的气体通入溴水 | 溴水褪色 | 乙烯和溴水发生加成反应 |
| C | 向物质的量浓度、体积均相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 水解程度:CO32->HCO3- |
| D | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 原Fe(NO3)2样品溶于酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
10.下列离子方程式正确的是( )
| A. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属钠投入MgCl2溶液中:2Na+Mg2+═2Na++Mg | |
| C. | 0.1mol/LNaHSO4溶液与0.1mol/LBa(OH)2溶液等体积混合:SO42-+Ba2+=BaSO4↓ | |
| D. | 硅酸钠水溶液中通入过量CO2:SiO32-+2H2O+2CO2═2HCO3-+H2SiO3↓ |
17.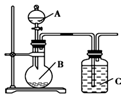 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )| A. | 稀H2SO4 | B. | Na2SO4溶液 | C. | Na2CO3溶液 | D. | Na2SiO3溶液 |
14.下列物质的熔点高低顺序,正确的是( )
| A. | 金刚石>晶体桂>碳化硅 | B. | Na>Mg>Al | ||
| C. | NaF<NaCl<NaBr | D. | CI4>CBr4>CCl4>CH4 |