题目内容
9.在①苯酚②甲苯③氯乙烷④乙烯⑤乙醇中,选择编号填写:(1)能和金属钠反应放出H2的有①⑤;
(2)能与NaOH溶液反应的有①③;
(3)常温下能与浓溴水反应的有①④;
(4)能使酸性KMnO4溶液褪色的烃有②④.
分析 (1)能与钠反应放出H2的有机物有:醇、羧酸、酚等;
(2)能与NaOH溶液反应的有机物有:羧酸、酯、卤代烃、酚;
(3)常温下能与浓溴水反应的有:烯烃、炔烃、酚、醛;
(4)含有碳碳双键或三键的有烃、苯环上含有支链且支链上连接苯环的第一个碳原子上含有氢原子的有机物都能被酸性高锰酸钾氧化.
解答 解:(1)①苯酚、⑤乙醇能与钠反应放出H2;故答案为:①⑤;
(2)①苯酚、③氯乙烷能与NaOH溶液反应;故答案为:①③;
(3)①苯酚、④乙烯常温下能与浓溴水反应;故答案为:①④;
(4)②甲苯、④乙烯是能使酸性KMnO4溶液褪色的烃;故答案为:②④.
点评 本题考查了有机物结构与性质,为高频考点,侧重考查学生的分析能力,题目难度不大,注意掌握常见有机物的结构与性质,把握反应的条件和类型.

练习册系列答案
相关题目
19.某元素的原子最外层有2个电子,则这种元素是( )
| A. | 金属元素 | B. | 惰性气体元素 | C. | 第二主族元素 | D. | 以上叙述都可能 |
20.对下列选项中的操作和现象,其解释与结论完全正确的是( )
| 选项 | 操作 | 现象 | 解释与结论 |
| A | 室温下,向浓度均为0.1mol•L-1的KCl和KI混合溶液中滴加AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 无水乙醇与浓硫酸共热至170℃,将产生的气体通入溴水 | 溴水褪色 | 乙烯和溴水发生加成反应 |
| C | 向物质的量浓度、体积均相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 水解程度:CO32->HCO3- |
| D | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 原Fe(NO3)2样品溶于酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
17. 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )| A. | 稀H2SO4 | B. | Na2SO4溶液 | C. | Na2CO3溶液 | D. | Na2SiO3溶液 |
14.下列物质的熔点高低顺序,正确的是( )
| A. | 金刚石>晶体桂>碳化硅 | B. | Na>Mg>Al | ||
| C. | NaF<NaCl<NaBr | D. | CI4>CBr4>CCl4>CH4 |
1.结构为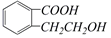 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:
①
②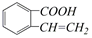
③
④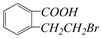
生成这四种有机物的反应类型依次为( )
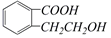 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:①

②

③

④
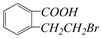
生成这四种有机物的反应类型依次为( )
| A. | 取代、消去、酯化、加成 | B. | 取代、消去、加聚、取代 | ||
| C. | 酯化、取代、缩聚、取代 | D. | 酯化、消去、氧化、取代 |
2. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
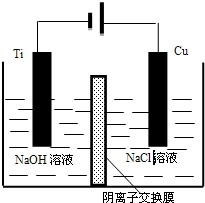
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如表所示.
下列叙述正确的是cd(填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如表所示.
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
3.(D2O)是重要的核工业原料,下列说法错误的是( )
| A. | 1H218O与D216O的相对分子质量相同 | |
| B. | 1H与D互称同位素 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 氘(D)原子核外有2个电子 |
 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.