题目内容
下列叙述正确的是( )
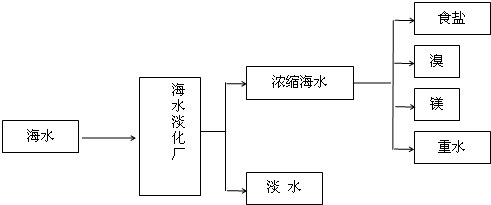
| A、海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” | |||
B、对于可逆反应N2(g)+3H2(g)
| |||
| C、硫酸工业中,从吸收塔上部导出的气体再次通入接触室进行二次氧化,进一步吸收后,二氧化硫的含量很少,可直接排放到空气中 | |||
| D、阴极射线和α-粒子散射现象都对原子结构模型的建立做出了贡献 |
考点:海水资源及其综合利用,化学反应速率的影响因素,常见的生活环境的污染及治理
专题:元素及其化合物,化学应用
分析:A、溴元素被称为“海洋元素”;
B、增大反应物浓度可增加单位体积活化分子数目,从而使反应速率增大,活化分子百分数不变;
C、二氧化硫为大气污染物,不能直接排放到空气中;
D、阴极射线和α-粒子散射现象都对原子结构模型的建立做出了贡献;
B、增大反应物浓度可增加单位体积活化分子数目,从而使反应速率增大,活化分子百分数不变;
C、二氧化硫为大气污染物,不能直接排放到空气中;
D、阴极射线和α-粒子散射现象都对原子结构模型的建立做出了贡献;
解答:
解:A、溴元素被称为“海洋元素”,故A错误;
B、增大反应物浓度可增加单位体积活化分子数目,从而使反应速率增大,活化分子百分数不变,故B错误;
C、二氧化硫为大气污染物,不能直接排放到空气中,故C错误;
D、1897年,英国科学家汤姆生通过阴极射线,发现了原子中存在电子,认识到原子是由更小的微粒构成的,提出了“葡萄干面包式”的原子结构模型.1911年,英国物理学家卢瑟福根据α粒子散射现象,发现了原子由原子核和核外电子构成的,从而提出了带核的原子结构行星模型.阴极射线和α-粒子散射现象都对原子结构模型的建立做出了贡献,故D正确;
故选D.
B、增大反应物浓度可增加单位体积活化分子数目,从而使反应速率增大,活化分子百分数不变,故B错误;
C、二氧化硫为大气污染物,不能直接排放到空气中,故C错误;
D、1897年,英国科学家汤姆生通过阴极射线,发现了原子中存在电子,认识到原子是由更小的微粒构成的,提出了“葡萄干面包式”的原子结构模型.1911年,英国物理学家卢瑟福根据α粒子散射现象,发现了原子由原子核和核外电子构成的,从而提出了带核的原子结构行星模型.阴极射线和α-粒子散射现象都对原子结构模型的建立做出了贡献,故D正确;
故选D.
点评:本题考查了海水资源利用,影响反应速率因素分析,掌握基础注意积累化学知识是关键,题目难度中等.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
 用铜片、银片、Cu(N03)2溶液、AgN03溶液、导线和盐桥(装有琼胶的KCl饱和溶液)构成一个原电池,下列叙述正确的是( )
用铜片、银片、Cu(N03)2溶液、AgN03溶液、导线和盐桥(装有琼胶的KCl饱和溶液)构成一个原电池,下列叙述正确的是( )| A、负褪羼应为:Ag++e-═Ag |
| B、在外电路中,电子从银电极流向铜电极 |
| C、盐桥中的Cl-移向Cu(N03)2溶液 |
| D、电池总反应为:Cu+2Ag+═Cu2++2Ag |
在一定温度下,向a L密闭容器中加入一定量A、B气体,发生如下反应:A2(g)+3B(g)?2C2 (g)+2D(g),可以作为反应达到平衡的标志是( )
| A、容器中总压强不随时间变化而变化 |
| B、单位时间内断裂一个A-A键,同时生成两个C-C键 |
| C、v正(B)=0.03mol/(L?s),v逆(D)=1.2mol/(L?min) |
| D、容器中气体的平均相对分子质量不随时间变化而变化 |
下列说法正确的是( )
| A、钢铁在潮湿的空气中发生的主要是化学腐蚀 |
| B、“PM2.5”是指直径小于或等于2.5微米的细小颗粒物,它悬浮在空气中形成胶体,严重危害人体健康 |
| C、电解质在水溶液和熔融状态下均能导电 |
| D、“血液透析”利用了胶体的性质 |
某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )


| A、a和b不连接时,铁片上会有金属铜析出 |
| B、a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu |
| C、无论a和b是否连接,均会产生气泡,a和b不连接时产生气泡的速率比a和b用导线连接时的速率快 |
| D、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
现有乙二醇(C2H6O2)、乙二醛(C2H2O2)、醋酸(CH3COOH)组成的混合物,测得其中氢元素的质量分数为9%,则混合物中氧元素的质量分数约为( )
| A、16% | B、37% |
| C、52% | D、无法确定 |
下列电离方程式中,书写正确的是( )
| A、KClO3=K++Cl-+3O2- |
| B、NaHCO3=Na++H++CO32ˉ |
| C、NaHSO4=Na++H++SO42ˉ |
| D、FeCl3=Fe3++Clˉ |
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色(已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀),则下列叙述正确的是( )
| A、原溶液中的Br-一定被氧化 |
| B、通入氯气之后原溶液中的Fe2+一定被氧化 |
| C、溶液中一定不存在Fe2+ |
| D、若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3 溶液,能产生黄色沉淀 |