题目内容
12.如图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性; F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸;C和D是两种常见的强酸;I是一种常见金属单质.请回答下列问题: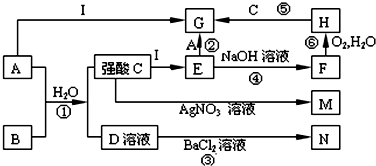
(1)写出反应①的化学方程式SO2+Cl2+2H2O=H2SO4+2HCl
(2)写出反应②的离子方程式2Fe2++Cl2=2Fe3++2Cl-
(3)F很不稳定,露置在空气中容易被氧化为H,该反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3; 保存 E溶液时应加入少量铁粉防止其被氧化.
(4)在①②③④⑤⑥中,属于氧化还原反应的有:①②⑥(填编号)
分析 A和B常温下都是气体,且水溶液都有漂白性,A应为Cl2,B应为SO2,M和N不溶于稀硝酸,可知M为AgCl,N为BaSO4,则C为HCl,D为H2SO4,由转化关系可知I为Fe,E为FeCl2,F为Fe(OH)2,H为Fe(OH)3,G为FeCl3,结合对应物质的性质以及题目要求可解答该题,
(1)反应①是二氧化硫和氯气在会容易在发生氧化还原反应生成硫酸和盐酸;
(2)反应②是氯化亚铁和氯气反应生成氯化铁;
(3)F为氢氧化亚铁被空气中的氧气氧化生成氢氧化铁;保存E溶液为氯化亚铁溶液,需要防止空气中的氧气氧化,需要加入铁粉;
(4)反应过程中元素化合价变化的反应为氧化还原反应.
解答 解:A和B常温下都是气体,且水溶液都有漂白性,A应为Cl2,B应为SO2,M和N不溶于稀硝酸,可知M为AgCl,N为BaSO4,则C为HCl,D为H2SO4,由转化关系可知I为Fe,E为FeCl2,F为Fe(OH)2,H为Fe(OH)3,G为FeCl3,结合对应物质的性质以及题目要求可解答该题,
(1)反应①是二氧化硫和氯气在会容易在发生氧化还原反应生成硫酸和盐酸,反应的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(2)反应②是氯化亚铁和氯气反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)F为氢氧化亚铁被空气中的氧气氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;保存E溶液为氯化亚铁溶液,需要防止空气中的氧气氧化,需要加入铁粉,铁和氯化铁溶液反应生成氯化亚铁,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;铁粉;
(4)反应过程中元素化合价变化的反应为氧化还原反应,在①②③④⑤⑥中,反应①是二氧化硫和氯气发生的氧化还原反应,②是氯化亚铁和氯气发生的氧化还原反应,③硫酸和氯化钡溶液反应生成硫酸钡沉淀,发生的是复分解反应不是氧化还原反应,④是氯化亚铁和氯气发生的氧化还原反应,⑤是氢氧化铁和盐酸反应生成氯化铁溶液时复分解反应,不是氧化还原反应,⑥是氢氧化亚铁和氧气、水发生的氧化还原反应,是氧化还原反应的是①②⑥,
故答案为:①②⑥.
点评 本题考查无机物的推断,题目难度中等,本题注意把握题给信息,结合物质的特性进行推断,为正确推断物质的种类为解答该题的关键,注意相关反应的化学方程式的书写,为易错点,注意体会.

| A. | ①②③④⑤ | B. | 只有⑤ | C. | ③④⑤ | D. | 只有①②③⑤ |
| A. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 标准状况下,2.24LCl2溶于足量NaOH中转移电子的数目为0.1NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/L NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NO | 水 |
| A. | A | B. | B | C. | C | D. | D |
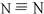 ,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式
,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式 ;
;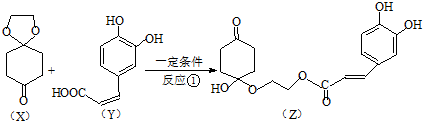
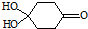 )分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
)分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如:
(已知烯醇式不稳定,会发生分子重排,例如: ).
).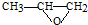 )发生类似反应①的反应,其生成物的结构简式为
)发生类似反应①的反应,其生成物的结构简式为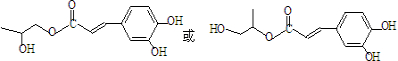 (写一种);
(写一种);