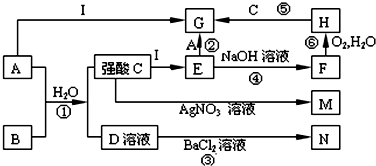
题目内容
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 标准状况下,2.24LCl2溶于足量NaOH中转移电子的数目为0.1NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
分析 A.2molNO与1molO2充分反应后生成2mol二氧化氮,但二氧化氮气体中存在平衡:2NO2?N2O4;
B.用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则说明阳极上放电生成了0.1mol氧气;
C.氯气与碱的反应是歧化反应;
D.过氧化钠与水反应时,氧元素的价态由-1价变为0价.
解答 解:A.2molNO与1molO2充分反应后生成2mol二氧化氮,但二氧化氮气体中存在平衡:2NO2?N2O4,导致分子个数变小,故容器中的分子数小于2NA个,故A错误;
B.用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则说明阳极上放电生成了0.1mol氧气,故转移了0.4mol电子即0.4NA个,故B错误;
C.氯气与碱的反应是歧化反应:Cl2+2NaOH=NaCl+NaClO+H2O,在此反应中,1molCl2转移1mol电子,在标况下,2.24 LCl2的物质的量为0.1mol,故转移0.1mol电子,故C正确;
D.过氧化钠与水反应时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,注意氯气与氢氧化钠反应为歧化反应,题目难度中等.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
10.有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如下表所示:
对应表中内容,下列叙述中正确的有多少句( )
(1)a、b、c的化学式分别为Ne、Br2、HF
(2)系列②物质均有氧化性;系列③物质对应水溶液均是强酸
(3)系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te
(4)上表内物质HF和H2O,由于氢键的影响,其分子特别稳定.
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
(1)a、b、c的化学式分别为Ne、Br2、HF
(2)系列②物质均有氧化性;系列③物质对应水溶液均是强酸
(3)系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te
(4)上表内物质HF和H2O,由于氢键的影响,其分子特别稳定.
| A. | 仅有一句 | B. | 两句 | C. | 三句 | D. | 全部正确 |
11.有一种酸式盐AHB,它的水溶液显弱碱性,今有下列说法,其中正确的是( )
| A. | 同浓度的AOH溶液和H2B溶液,电离程度前者大于后者 | |
| B. | HB-的电离程度大于HB-的水解程度 | |
| C. | 该盐的电离方程式为AHB═A++H++B2- | |
| D. | 在溶液中离子浓度大小顺序一般为.c(A+)>c(HB-)>c(OH-)>c(B2-)>c(H+) |
8.现有下列短周期元素性质的数据:
试回答下列问题:
(1)上述元素中处于同一主族的有④和⑦、③和⑥,处于第3周期的有②④⑤⑥(以上均用 编号表示).
(2)元素④与元素⑦相比较,气态氢化物较稳定的是NH3(填气态氢化物的化学式).
(3)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与CO2反应的化学方程式:2Na2O2+2CO2=Na2CO3+O2;
(4)上表中某元素最高价氧化物对应的水化物能溶于盐酸和氢氧化钠,该元素的单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素编号元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于同一主族的有④和⑦、③和⑥,处于第3周期的有②④⑤⑥(以上均用 编号表示).
(2)元素④与元素⑦相比较,气态氢化物较稳定的是NH3(填气态氢化物的化学式).
(3)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与CO2反应的化学方程式:2Na2O2+2CO2=Na2CO3+O2;
(4)上表中某元素最高价氧化物对应的水化物能溶于盐酸和氢氧化钠,该元素的单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
15.下列说法错误的是( )
| A. | 对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理 | |
| B. | 氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 | |
| C. | 对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 | |
| D. | 电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极 |
5.下列离子方程式正确的是( )
| A. | 向NaOH溶液中通入过量的SO2:SO2+20H-═SO32-+H20 | |
| B. | Na2O2和H2O反应:Na2O2+H2O═2Na++20H-+02↑ | |
| C. | Cl2和H2O反应:Cl2+H20═2H++Cl-+Cl0- | |
| D. | SiO2+2OH-═SiO32-+H2O |
9.下列有关分子晶体的说法中正确的是( )
| A. | 分子内均存在共价键 | B. | 分子间一定存在范德华力 | ||
| C. | 分子间一定存在氢键 | D. | 其结构一定为分子密堆积 |
10.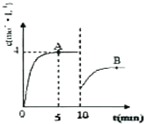 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.在10min时采取的措施是移去部分氨气,点A的平衡常数K=(填“<”、“>”或“=”)B点的平衡常数.
(3)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如表:
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2v正(H2)(正)=3v逆(NH3) B.v正(N2)=3v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.计算该条件下的平衡常数为0.4(L/mol)2.
 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.在10min时采取的措施是移去部分氨气,点A的平衡常数K=(填“<”、“>”或“=”)B点的平衡常数.
(3)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如表:
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2v正(H2)(正)=3v逆(NH3) B.v正(N2)=3v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.计算该条件下的平衡常数为0.4(L/mol)2.