题目内容
18.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 常温常压下,2.0g重水(D2O)中含NA个电子 | |
| C. | 1.0L0.1mo1•L-1的NaHCO3溶液中含HCO3-和CO32-的离子数之和为0.1NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g |
分析 A.标准状况下二氯甲烷不是气体;
B.物质的量n=$\frac{m}{M}$,D2O中含有10个电子,摩尔质量是20g/mol;
C.溶液中存在物料守恒,n(Na)=n(C);
D.电解精炼铜时,阳极上是粗铜,粗铜上有其他金属杂质;
解答 解:A.在标况下,二氯甲烷不是气体,题中条件无法计算22.4L二氯甲烷的物质的量,故A错误;
B.2.0g重水(D2O)的物质的量是=$\frac{2.0g}{20g/mol}$=0.1mol,D2O分子中含有10个电子,含有的电子数为NA,故B正确;
C.1.0L0.1mo1•L-1的NaHCO3溶液中存在物料守恒,含HCO3-、CO32-、H2CO3离子数之和为0.1NA,故C错误;
D.电解精炼铜时,阳极上是粗铜,粗铜上有其他比铜活泼的金属杂质也会放电,故阴极得到电子数为2NA时,阳极减少的质量不一定是64g,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用、微粒结构和微粒数目的计算、电解质溶液中物料守恒、电极精炼原理等知识,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
8.根据下列操作、现象,所得结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色. 后者为红褐色 | 温度升高,Fe3+的水解 程度增大 |
| B | NaOH的乙醇溶液与溴乙烷共热,产生的气体通入 酸性高锰酸钾溶液中 | 溶液褪色 | 产生的气体为乙烯 |
| C | 铜铝合金加入一定量稀硝酸中,有金属剩余,再加稀硫酸 | 剩余金属质量减小 | 铝与稀硫酸反应使 剩余金属质量减小 |
| D | 盛有NO2的集气瓶中加入一定量水 | 气体变为无色 | NO2是酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
9.晚唐诗人李商隐的《无题•相见时难别亦难》中写到“春蚕到死丝方尽,蜡炬成灰泪始干”,下列说法正确的是( )
| A. | 蚕丝属于纤维素 | |
| B. | 蜡烛的主要成分是石蜡,属于混合物 | |
| C. | “泪”是指石蜡燃烧生成的水 | |
| D. | 蚕丝和石蜡完全燃烧所得产物相同 |
13.如图为立方烷的结构简式,其二氯代物有( )


| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
3.要除去Cu(OH)2中混有的Al(OH)3,最好的方法是( )
| A. | 用盐酸洗涤过滤 | B. | 用加热还原 | ||
| C. | 用CO加热还原 | D. | 用NaOH溶液洗涤,过滤 |
10.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag++e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ |
7.锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O═2Zn(OH)42-.下列说法正确的是( )
| A. | 充电时,电解质溶液中K+向阳极移动 | |
| B. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| C. | 放电时,负极反应为:Zn+4OH--2e-═Zn(OH)42- | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
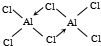 (标出配位键).
(标出配位键).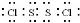 ,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.
,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.