题目内容
15.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )| A. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 1mol N2与4mol H2反应生成的NH3分子数为2NA | |
| C. | 1mol Fe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的共价键数为0.4NA |
分析 A.乙烯和丙烯最简式CH2,计算14gCH2中的氢原子数;
B.氮气和氢气反应生成氨气是可逆反应;
C.1mol Fe溶于过量硝酸生成硝酸铁,依据反应的铁计算电子转移;
D.标准状况下四氯化碳不是气体.
解答 解:A.14g乙烯和丙烯混合气体中含CH2物质的量=$\frac{14g}{14g/mol}$=1mol,含氢原子数为2NA,故A正确;
B.1mol N2与4mol H2反应生成的NH3,反应为可逆反应1mol氮气不能全部反应生成氨气,生成氨气分子数小于2NA,故B错误;
C.1mol Fe溶于过量硝酸生成硝酸铁,电子转移为3mol,电子转移数为3NA,故C错误;
D.标准状况下,四氯化碳不是气体,2.24L CCl4含物质的量不是0.1mol,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质组成、氧化还原反应、可逆反应、气体摩尔体积等知识点的应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
3.要除去Cu(OH)2中混有的Al(OH)3,最好的方法是( )
| A. | 用盐酸洗涤过滤 | B. | 用加热还原 | ||
| C. | 用CO加热还原 | D. | 用NaOH溶液洗涤,过滤 |
10.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag++e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ |
7.锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O═2Zn(OH)42-.下列说法正确的是( )
| A. | 充电时,电解质溶液中K+向阳极移动 | |
| B. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| C. | 放电时,负极反应为:Zn+4OH--2e-═Zn(OH)42- | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |

 .
.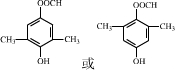 .
. $\stackrel{P_{2}O_{5}}{→}$
$\stackrel{P_{2}O_{5}}{→}$ .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
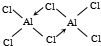 (标出配位键).
(标出配位键).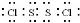 ,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.
,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.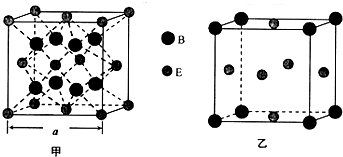




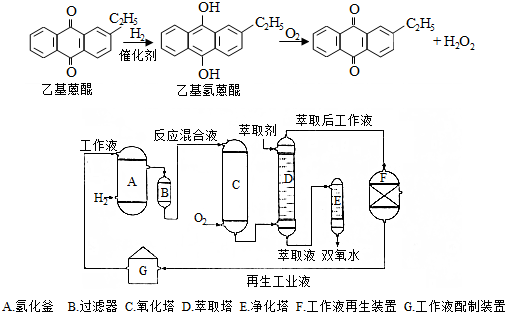
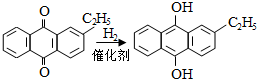 .进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.
.进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.