题目内容
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 100 mL 0.2 mol•L-1蔗糖溶液中所含分子总数为0.02NA | |
| B. | 40mL 10mol•L-1的浓盐酸与足量的MnO2充分反应,生成氯气的分子数为0.1NA | |
| C. | 标准状况下,22.4L CHCl3中含有的氯原子数目为3NA | |
| D. | 14g CO 和N2混合气体中含有的电子总数为7NA |
分析 A、蔗糖溶液中除了蔗糖分子,还有水分子;
B、二氧化锰只与浓盐酸反应;
C、标况下三氯甲烷为液体;
D、CO和氮气的摩尔质量均为28g/mol,且均含14个电子.
解答 解:A、蔗糖溶液中除了蔗糖分子,还有水分子,故溶液中的分子总数多于0.02NA个,故A错误;
B、二氧化锰只与浓盐酸反应,和稀盐酸不反应,故盐酸不能反应完全,故生成的氯气分子个数小于0.1NA个,故B错误;
C、标况下三氯甲烷为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、CO和氮气的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,而且两者均含14个电子,故0.5mol混合物中含7NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
13.下列气体可用如图所示方法收集的是( )
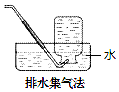

| A. | NO2 | B. | O2 | C. | SO2 | D. | NH3 |
12.化学在生活中有着广泛的应用,下列物质的性质与用途对应关系错误的是( )
| 物质 | 性质 | 用途 | |
| A | Fe2O3 | 红棕色粉末 | 常用作红色油漆和颜料 |
| B | NaHCO3 | 溶液呈碱性 | 可用作食用碱或工业用碱 |
| C | Si | 导电性介于道题与绝缘体之间 | 用于制作计算机芯片、光电池 |
| D | SO2 | 还原性 | 工业上用来漂白纸浆、毛、丝、草帽辫等 |
| A. | A | B. | B | C. | C | D. | D |
19.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 含NA个Na+的NaOH溶于1L水中形成溶液的物质的量浓度为lmol•L-1 | |
| B. | 总质量为18g的H216O和H218O所含分子数为NA | |
| C. | 常温常压下,22.4L的CO2与Mg完全反应,转移电子数为4NA | |
| D. | 硫酸的摩尔质量与NA个硫酸分子的质量在数值上相等 |
9.向3mol•L-1盐酸中加入打磨后的镁条,一段时间后生成灰白色固体X,并测得反应后溶液pH升高.为确认固体X的成分,过滤洗涤后进行实验:
①向固体X中加入足量硝酸,固体溶解,得到无色溶液,将其分成两等份;
②向其中一份无色溶液中加入足量AgNO3溶液,得到白色沉淀a;
③向另一份无色溶液中加入足量NaOH溶液,得到白色沉淀b.
下列分析不正确的是( )
①向固体X中加入足量硝酸,固体溶解,得到无色溶液,将其分成两等份;
②向其中一份无色溶液中加入足量AgNO3溶液,得到白色沉淀a;
③向另一份无色溶液中加入足量NaOH溶液,得到白色沉淀b.
下列分析不正确的是( )
| A. | 溶液pH升高的主要原因:Mg+2H+═Mg2++H2↑ | |
| B. | 生成沉淀a的离子方程式:Ag++Cl-═AgCl↓ | |
| C. | 沉淀b是Mg(OH)2 | |
| D. | 若a、b的物质的量关系为n(a):n(b)=1:3,则可推知固体X的化学式为Mg3(OH)6Cl |
16.下列有关实验操作、实验现象和所得结论均正确的是( )
| 实验操作 | 实验现象 | 结论 | |
| A | 将SO2通人溴水中 | 溴水颜色褪去 | SO2具有漂白性 |
| B | 将铁屑放入稀HNO3中 | 放出无色气体 | Fe比H2活泼 |
| C | 将澄清石灰水滴入某溶液 | 生成白色沉淀 | 溶液中存CO32- |
| D | 将乙烯通入KMnO4酸性溶液 | KMnO4颜色褪去 | 乙烯具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关化学用语表达正确的是( )
| A. | 氟化氢的电子式: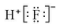 | |
| B. | 氯原子的结构示意图: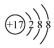 | |
| C. | 丙烯的结构简式:C3H6 | |
| D. | 硫原子的最外层电子排布式:3s23p4 |
6.进行一氯取代反应后,只能生成 2 种沸点不同的产物的烷烃是( )
| A. | (CH3)2CHCH2CH3 | B. | CH3CH2CH2CH2CH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH2CH3 |



