题目内容
6.进行一氯取代反应后,只能生成 2 种沸点不同的产物的烷烃是( )| A. | (CH3)2CHCH2CH3 | B. | CH3CH2CH2CH2CH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH2CH3 |
分析 进行一氯取代反应后,只能生成 2 种沸点不同的产物,则有机物中含2种H,结合有机物结构的对称性分析H的种类,以此来解答.
解答 解:A.(CH3)2CHCH2CH3中含4种H,故A不选;
B.CH3CH2CH2CH2CH3中含3种H,故B选;
C.(CH3)2CHCH(CH3)2中含2种H,故C选;
D.(CH3)3CCH2CH3中含3种H,故D不选;
故选C.
点评 本题考查有机物的结构,为高频考点,把握有机物结构对称性判断H的种类为解答的关键,侧重分析与应用能力的考查,注意与同一个碳相连的甲基相同,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 100 mL 0.2 mol•L-1蔗糖溶液中所含分子总数为0.02NA | |
| B. | 40mL 10mol•L-1的浓盐酸与足量的MnO2充分反应,生成氯气的分子数为0.1NA | |
| C. | 标准状况下,22.4L CHCl3中含有的氯原子数目为3NA | |
| D. | 14g CO 和N2混合气体中含有的电子总数为7NA |
5.氮化硅(Si3N4)是一种新型的耐高温耐磨材料,氮化硅属于( )
| A. | 离子晶体 | B. | 分子晶体 | C. | 金属晶体 | D. | 原子晶体 |
2.实验室用如图所示的装置蒸馏海水,下列说法正确的是( )
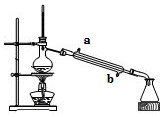

| A. | 蒸馏烧瓶中加入沸石的作用是防止暴沸 | |
| B. | 实验时冷却水应从a进入,从b流出 | |
| C. | 锥形瓶中能收集到高浓度的氯化钠溶液 | |
| D. | 该装置可用于分离海水中的NaCl和MgCl2 |
11.下列化合物中与自身类别相同的同分异构体数目最多的是( )
| A. | 戊烷 | B. | 丙醇 | C. | 丙酸 | D. | 乙酸乙酯 |
15. 在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:
在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:
(1)该反应的平衡常数表达式为$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;从表中数据分析:c1<c2;(填“>”“<”或“=”).
(2)在图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为0.001mol•L-1•s-1.
(4)随温度升高,混合气体的颜色变深,反应的△H>0(填“大于”“小于”)
(5)达平衡后下列条件的改变可使NO2气体浓度增大的是B.
A.增大容器的容积B.再充入一定量的N2O4C.分离出一定量的NO2D.再充入一定量的He
(6)若起始时充入NO2气体0.080mol,N2O4气体0.010mol,通过计算判断反应进行的方向.
 在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:
在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | 0.040 | 0.040 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(2)在图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为0.001mol•L-1•s-1.
(4)随温度升高,混合气体的颜色变深,反应的△H>0(填“大于”“小于”)
(5)达平衡后下列条件的改变可使NO2气体浓度增大的是B.
A.增大容器的容积B.再充入一定量的N2O4C.分离出一定量的NO2D.再充入一定量的He
(6)若起始时充入NO2气体0.080mol,N2O4气体0.010mol,通过计算判断反应进行的方向.
16.下列各组离子在给定条件下一定能大量共存的是( )
| A. | 滴加甲基橙显红色的溶液中:Na+、K+、Cl-、ClO- | |
| B. | 滴入KSCN显血红色的溶液中:Na+、Mg2+、SO42-、Br- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1012mol/L的溶液中:K+、Na+、NO3-、HCO3- | |
| D. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:NH4+、Fe2+、NO3-、SO42- |

 .
.