题目内容
12.化学在生活中有着广泛的应用,下列物质的性质与用途对应关系错误的是( )| 物质 | 性质 | 用途 | |
| A | Fe2O3 | 红棕色粉末 | 常用作红色油漆和颜料 |
| B | NaHCO3 | 溶液呈碱性 | 可用作食用碱或工业用碱 |
| C | Si | 导电性介于道题与绝缘体之间 | 用于制作计算机芯片、光电池 |
| D | SO2 | 还原性 | 工业上用来漂白纸浆、毛、丝、草帽辫等 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.依据氧化铁为红棕色固体解答;
B.依据碳酸氢钠水解的性质、不稳定性解答;
C.依据硅为良好的半导体材料解答;
D.依据二氧化硫的漂白性解答.
解答 解:A.氧化铁为红棕色固体,常用于红色油漆和颜料,化学式为:Fe2O3,故A正确;
B.碳酸氢钠不稳定受热分解生成二氧化碳,可以用于发酵剂和工业用碱,碳酸氢钠为水解显碱性,故B正确;
C.硅导电性介于道题与绝缘体之间,是良好的半导体材料,用于制作计算机芯片、光电池,故C正确;
D.工业上用来二氧化硫漂白纸浆、毛、丝、草帽辫等,是利用二氧化硫的漂白性,故D错误;
故选:D.
点评 本题考查较为综合,涉及物质的性质与应用,为高考常见题型,侧重考查化学与生活、生产等知识,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质.己知:
请回答下列问题:
(1)25℃时,0.10mol•L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)=10-3
(2)常温下,将20mL0.10mol•L-1CH3COOH溶液和 20mL0.10mol•L-1HNO2 溶液分别与 20mL 0.10mol•L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计).
①反应开始时,v (CH3COOH )<v (HNO2)(填“>”、“<”或“:”).
②充分反应后.两溶液中c(CH3COO-)< c(NO2-)(填“>”、“<”或“=”).
(3)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18;
(4)常温下,下列方法可以使0.1mol•L-1CH3COOH的电离程度增大的是bc.
a.加入少量的稀盐酸
b.加热溶液
c.加水稀释
d.加入少量冰醋酸.
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数 | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
(1)25℃时,0.10mol•L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)=10-3
(2)常温下,将20mL0.10mol•L-1CH3COOH溶液和 20mL0.10mol•L-1HNO2 溶液分别与 20mL 0.10mol•L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计).
①反应开始时,v (CH3COOH )<v (HNO2)(填“>”、“<”或“:”).
②充分反应后.两溶液中c(CH3COO-)< c(NO2-)(填“>”、“<”或“=”).
(3)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18;
(4)常温下,下列方法可以使0.1mol•L-1CH3COOH的电离程度增大的是bc.
a.加入少量的稀盐酸
b.加热溶液
c.加水稀释
d.加入少量冰醋酸.
20.下列生活中常见用品与其类别或主要成分对应不正确的是( )
| A | B | C | D | |
| 用品名称 |  太阳能电池 |  食用油 |  84消毒液 |  合成纤维宇航服 |
| 类别或 主要成分 | SiO2 | 酯类物质 | 混合物 | 高分子材料 |
| A. | A | B. | B | C. | C | D. | D |
7. 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐渐加入4mol•L-1NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示(不考虑沉淀的微量溶解).下列说法正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐渐加入4mol•L-1NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示(不考虑沉淀的微量溶解).下列说法正确的是( )
 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐渐加入4mol•L-1NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示(不考虑沉淀的微量溶解).下列说法正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐渐加入4mol•L-1NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示(不考虑沉淀的微量溶解).下列说法正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)═c(OH-)+c(NO3-) | |
| B. | EF段发生反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | D点溶液中n(NH4+)=0.012mol | |
| D. | 由水电离产生的c(H+):O点>F点 |
17.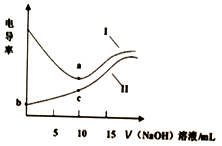 用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
 用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )| A. | b点pH值大于1 | B. | 盐酸浓度为 0.lmol•L-1 | ||
| C. | c点:c(Na+)>c(A-)>c(H+)>c(OH-) | D. | 曲线Ⅰ为盐酸,曲线Ⅱ为醋酸溶液 |
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 100 mL 0.2 mol•L-1蔗糖溶液中所含分子总数为0.02NA | |
| B. | 40mL 10mol•L-1的浓盐酸与足量的MnO2充分反应,生成氯气的分子数为0.1NA | |
| C. | 标准状况下,22.4L CHCl3中含有的氯原子数目为3NA | |
| D. | 14g CO 和N2混合气体中含有的电子总数为7NA |
2.实验室用如图所示的装置蒸馏海水,下列说法正确的是( )
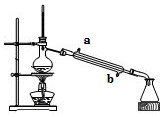

| A. | 蒸馏烧瓶中加入沸石的作用是防止暴沸 | |
| B. | 实验时冷却水应从a进入,从b流出 | |
| C. | 锥形瓶中能收集到高浓度的氯化钠溶液 | |
| D. | 该装置可用于分离海水中的NaCl和MgCl2 |
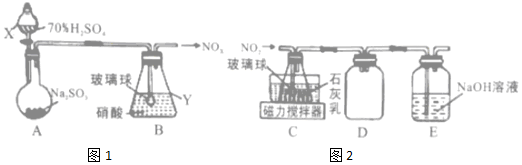
 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下: