题目内容
化学反应终点的判断是化学定量实验的重要环节.下列对化学反应终点的判断不正确的是
A.向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀
B.淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有砖红色沉淀生成,说明淀粉已经完全水解
C.将Na2SO4?10H2O晶体置于坩埚中加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水
D.用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,说明NaOH已完全中和
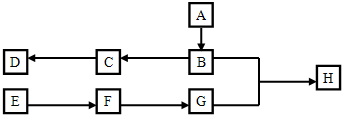
工业上用铝土矿(主要成分是Al2O3和少量的另外两种氧化物)提取冶炼铝的原料氧化铝.工艺流程如下图:
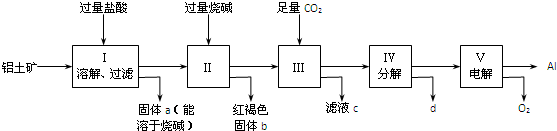
(1)铝土矿中所含元素在地壳中的含量位于前四位,则所含两种杂质是 、 .
(2)步骤Ⅲ中发生反应的离子方程式是 .
(3)步骤Ⅴ中的阳极反应式是 .
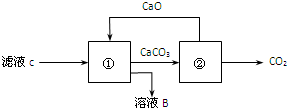
(4)滤液c可通过如下方法转化为溶液B和气体C而循环使用,则①中发生反应的化学方程式为
A.向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀
B.淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有砖红色沉淀生成,说明淀粉已经完全水解
C.将Na2SO4?10H2O晶体置于坩埚中加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水
D.用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,说明NaOH已完全中和
工业上用铝土矿(主要成分是Al2O3和少量的另外两种氧化物)提取冶炼铝的原料氧化铝.工艺流程如下图:

(1)铝土矿中所含元素在地壳中的含量位于前四位,则所含两种杂质是
(2)步骤Ⅲ中发生反应的离子方程式是
(3)步骤Ⅴ中的阳极反应式是
(4)滤液c可通过如下方法转化为溶液B和气体C而循环使用,则①中发生反应的化学方程式为

考点:物质分离和提纯的方法和基本操作综合应用,化学实验方案的评价
专题:实验探究和数据处理题,实验设计题
分析:A.沉淀完全的检验方法为:取少量上层清液于小试管中,滴加沉淀剂,若不再有沉淀产生,则沉淀完全;若还有沉淀生成,则不完全;
B.淀粉在稀硫酸的作用下水解后,只要淀粉水解,就有葡萄糖生成,在碱性条件下,能和氢氧化铜反应;
C.相邻两次称量的结果相同,说明固体已经恒重,说明硫酸钠已全部失去结晶水;
D.滴有酚酞的NaOH溶液呈粉红色,当滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明碱已全部反应完;
(1)根据地壳中的含量位于前四位的分别为O、Si、Al、Fe,所以所含两种杂质氧化硅和氧化铁;
(2-3)由于SiO2和盐酸不反应,固体a为SiO2,滤液Ⅰ中含有AlCl3、FeCl3,过量的烧碱与AlCl3反应生成偏铝酸钠与FeCl3反应生成红褐色的沉淀氢氧化铁,所以固体b为Fe(OH)3,滤液Ⅱ中含有偏铝酸钠,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠溶液,所以滤液c为碳酸氢钠溶液,Ⅳ是氢氧化铝分解生成氧化铝和水,Ⅴ为电解熔融氧化铝生成铝单质和氧气,以此解答该题.
(4)根据以上分析滤液c为碳酸氢钠溶液,结合流程反应①即碳酸氢钠与氢氧化钙反应生成碳酸钙和氢氧化钠;
B.淀粉在稀硫酸的作用下水解后,只要淀粉水解,就有葡萄糖生成,在碱性条件下,能和氢氧化铜反应;
C.相邻两次称量的结果相同,说明固体已经恒重,说明硫酸钠已全部失去结晶水;
D.滴有酚酞的NaOH溶液呈粉红色,当滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明碱已全部反应完;
(1)根据地壳中的含量位于前四位的分别为O、Si、Al、Fe,所以所含两种杂质氧化硅和氧化铁;
(2-3)由于SiO2和盐酸不反应,固体a为SiO2,滤液Ⅰ中含有AlCl3、FeCl3,过量的烧碱与AlCl3反应生成偏铝酸钠与FeCl3反应生成红褐色的沉淀氢氧化铁,所以固体b为Fe(OH)3,滤液Ⅱ中含有偏铝酸钠,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠溶液,所以滤液c为碳酸氢钠溶液,Ⅳ是氢氧化铝分解生成氧化铝和水,Ⅴ为电解熔融氧化铝生成铝单质和氧气,以此解答该题.
(4)根据以上分析滤液c为碳酸氢钠溶液,结合流程反应①即碳酸氢钠与氢氧化钙反应生成碳酸钙和氢氧化钠;
解答:
解:A.向BaCl2溶液中加入适量Na2CO3溶液后,发生反应:BaCl2 +Na2CO3 =BaCO3↓+2NaCl,
少量上层清液于小试管中,滴加Na2CO3,若不再有沉淀产生,则沉淀完全;若还有沉淀生成,则不完全,故A正确;
B.淀粉在稀硫酸的作用下水解后,只要淀粉水解,就有葡萄糖生成,淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,只能说明有淀粉水解,但不能说明淀粉不能完全水解,故B错误;
C.将Na2SO4?10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明固体已经恒重,说明硫酸钠已全部失去结晶水,故C正确;
D.滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,滴有酚酞的NaOH溶液呈粉红色,当滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明碱已全部反应完,故D正确;
故选:B;
(1)根据地壳中的含量位于前四位的分别为O、Si、Al、Fe,所以所含两种杂质氧化硅和氧化铁,故答案为:SiO2;Fe2O3;
(2)步骤Ⅲ中向滤液Ⅱ中通入二氧化碳气体,又根据以上分析,滤液Ⅱ中含有NaAlO2,故反应的离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)根据以上分析,Ⅴ为电解熔融氧化铝生成铝单质和氧气,所以阳极反应为:2O2--4e-=O2↑,故答案为:2O2--4e-=O2↑;
(4)根据以上分析滤液c为碳酸氢钠溶液,结合流程反应①即碳酸氢钠与氢氧化钙反应生成碳酸钙和氢氧化钠,所以①中发生反应的化学方程式为:CaO+H2O=Ca(OH)2、Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O,故答案为:CaO+H2O=Ca(OH)2、Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O;
少量上层清液于小试管中,滴加Na2CO3,若不再有沉淀产生,则沉淀完全;若还有沉淀生成,则不完全,故A正确;
B.淀粉在稀硫酸的作用下水解后,只要淀粉水解,就有葡萄糖生成,淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,只能说明有淀粉水解,但不能说明淀粉不能完全水解,故B错误;
C.将Na2SO4?10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明固体已经恒重,说明硫酸钠已全部失去结晶水,故C正确;
D.滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,滴有酚酞的NaOH溶液呈粉红色,当滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明碱已全部反应完,故D正确;
故选:B;
(1)根据地壳中的含量位于前四位的分别为O、Si、Al、Fe,所以所含两种杂质氧化硅和氧化铁,故答案为:SiO2;Fe2O3;
(2)步骤Ⅲ中向滤液Ⅱ中通入二氧化碳气体,又根据以上分析,滤液Ⅱ中含有NaAlO2,故反应的离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)根据以上分析,Ⅴ为电解熔融氧化铝生成铝单质和氧气,所以阳极反应为:2O2--4e-=O2↑,故答案为:2O2--4e-=O2↑;
(4)根据以上分析滤液c为碳酸氢钠溶液,结合流程反应①即碳酸氢钠与氢氧化钙反应生成碳酸钙和氢氧化钠,所以①中发生反应的化学方程式为:CaO+H2O=Ca(OH)2、Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O,故答案为:CaO+H2O=Ca(OH)2、Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O;
点评:考查化学反应终点判断的知识,反应方程式以及电极方程式的书写,难度中等,充分理解物质之间相互作用反应的原理和清楚反应过程是解题的关键.

练习册系列答案
相关题目
已知:H2(g)+F2(g)═2HF(g)△H=-270kJ?mol-1,下列说法正确的是( )
| A、2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 |
| B、1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| C、在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 |
| D、1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
下列关于氨碱法(索氏)和联合制碱法(侯氏)说法错误的是( )
| A、两者的原料来源相同 |
| B、两者的生产原理相同 |
| C、两者对食盐利用率不同 |
| D、两者最终产品都是Na2CO3 |
 )为主要原料来进行的有机合成:
)为主要原料来进行的有机合成: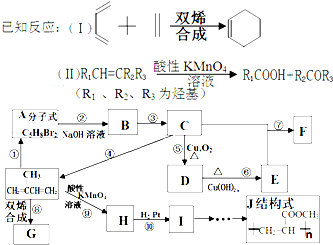
 某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2