题目内容
1. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
②C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5kJ•mol-1
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s);△H=-157kJ•mol-1
则方法a发生的热化学方程式是:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+34.5kJ/mol.
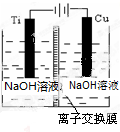
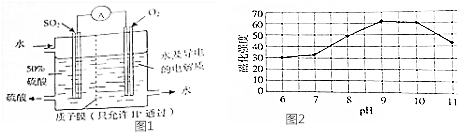
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为阴离子交换膜(填“阴”或“阳”),该电池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O,钛极附近的pH值增大(填“增大”“减小”或“不变”).
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
| 序号 | 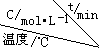 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
②实验①前20min的平均反应速率 v(O2)=3.5×10-5mol/(L•min).
分析 (1)根据盖斯定律结合热化学方程式的书写方法来书写;
(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子浓度,在电解池的阳极发生失电子的氧化反应;钛极是阴极发生氢离子得电子的还原反应,据此分析附近pH值变化;
(3)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(4)①该反应的正反应是吸热反应,升高温度平衡正向移动,水蒸气的转化率增大;
②先计算水蒸气反应速率,再根据同一反应中同一段时间内各物质的反应速率之比等于其计量数之比计算氧气反应速率.
解答 解:(1)已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-169kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ•mol-1,
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-157kJ•mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu2O(s)+CO(g)
该反应可以是②-③×2-$\frac{1}{2}$×①,反应的焓变是-110.5kJ•mol-1-(-157kJ•mol-1×2)-$\frac{1}{2}$×(-169kJ•mol-1)=34.5kJ•mol-1,
故答案为:C(s)+2CuO (s)=Cu2O(s)+CO(g)△H=+34.5kJ•mol-1;
(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子浓度;在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,钛极是阴极发生氢离子得电子的还原反应,所以消耗氢离子,则PH值增大,故答案为:阴;2Cu-2e-+2OH-=Cu2O+H2O;增大;
(3)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O,故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O;
(4)①该反应的正反应是吸热反应,升高温度平衡正向移动,水蒸气的转化率增大,②和③相比,③转化率高,所以T2>T1,故答案为:>;
②前20min内水蒸气反应速率=$\frac{0.050-0.0486}{20-0}$mol/(L.min)=7×10-5mol/(L•min),
同一反应中同一段时间内各物质的反应速率之比等于其计量数之比,则氧气反应速率=3.5×10-5mol/(L•min),故答案为:3.5×10-5mol/(L•min).
点评 本题考查物质制备,为高频考点,涉及化学平衡有关计算、电解原理、盖斯定律等知识点,侧重考查学生分析计算能力,难点是电极反应式的书写,题目难度中等.

 名师伴你成长课时同步学练测系列答案
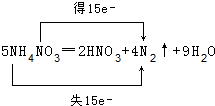
名师伴你成长课时同步学练测系列答案2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑
现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.440g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol•L-1的KMnO4标准溶液进行滴定,三次结果如下:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
| 标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
(1)滴定时,KMnO4标准溶液应该装在酸式(填酸式或碱式)滴定管中.
(2)在整个实验过程中,不需要的仪器或用品是④⑥(填序号).
①100mL容量瓶 ②烧杯 ③滴定管夹 ④漏斗 ⑤玻璃棒 ⑥托盘天平
(3)到达滴定终点的标志是加入最后一滴KMnO4溶液,溶液变为浅紫红色,且30s内不褪色.
(4)根据上述数据计算X=3.
(5)若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值偏高(填:偏高、偏低、无影响).
(6)若KMnO4标准溶液浓度偏低,则X值偏低(填:偏高、偏低、无影响).
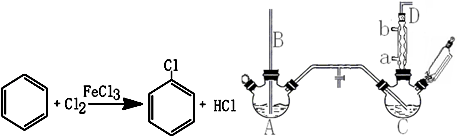
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
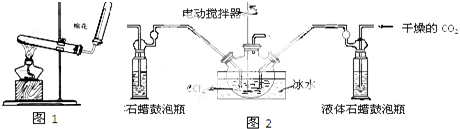
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl和HCl+NaOH=NaCl+H2O(写两个即可).
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
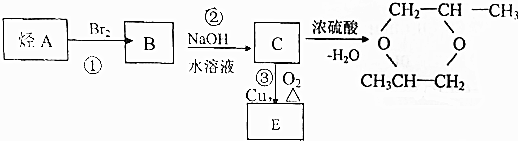

 ;5:3.
;5:3.