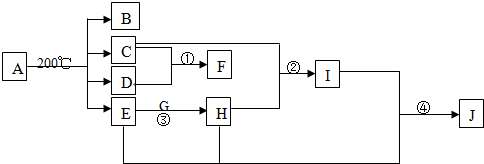
题目内容
已知下列几种化学键的键能:
请计算下列反应的反应热:
(1)H2(g)+Cl2(g)=2HCl(g)△H= ;
(2)50mL 0.50mol?L-1盐酸与50mL 0.55mol/L NaOH溶液简易量热计中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(a)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”).
(b)酸、碱混合时,把量筒中的NaOH溶液缓缓倒入小烧杯中测得的中和热的数值会 .(填“偏大”“偏小”“无影响”)
(c) 实验中用环形铜丝搅拌棒代替 ,测得的中和热的数值会 .(均填“偏大”“偏小”“无影响”)
| 化学键 | Si-Si键 | H-H键 | Cl-Cl键 | H-Cl键 | Si-Cl键 |
| 键能(KJ/mol) | 176 | 436 | 243 | 431 | 360 |
(1)H2(g)+Cl2(g)=2HCl(g)△H=
(2)50mL 0.50mol?L-1盐酸与50mL 0.55mol/L NaOH溶液简易量热计中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(a)大烧杯上如不盖硬纸板,求得的中和热数值
(b)酸、碱混合时,把量筒中的NaOH溶液缓缓倒入小烧杯中测得的中和热的数值会
(c) 实验中用环形铜丝搅拌棒代替
考点:中和热的测定,有关反应热的计算
专题:
分析:(1)根据反应热=反应物的总键能-生成物的总键能来分析;
(2)(a)大烧杯上如不盖硬纸板,会使一部分热量散失;
(b)酸碱混合时要迅速,并且不能搅拌,防止热量的散失;
(c)根据金属的导热性很好,会导致热量的散失;
(2)(a)大烧杯上如不盖硬纸板,会使一部分热量散失;
(b)酸碱混合时要迅速,并且不能搅拌,防止热量的散失;
(c)根据金属的导热性很好,会导致热量的散失;
解答:
解:(1)反应热=436KJ/mol+243 KJ/mol-431KJ/mol×2=-183.0 KJ/mol,故答案为:-183.0 KJ/mol;
(2)(a)大烧杯上如不盖硬纸板,会使一部分热量散失,最高温度偏低,使测得的△H数值偏小;
故答案为:偏小;
(b)酸、碱混合时,把量筒中的NaOH溶液缓缓倒入小烧杯中,会使一部分热量散失,最高温度偏低,使测得的△H数值偏小;
故答案为:偏小;
(c) 实验中用环形铜丝搅拌棒代替代替环形玻璃搅拌棒,金属的导热性很好,会导致热量的散失,最高温度偏低,使测得的△H数值偏小;
故答案为:环形玻璃搅拌棒;偏小;
(2)(a)大烧杯上如不盖硬纸板,会使一部分热量散失,最高温度偏低,使测得的△H数值偏小;
故答案为:偏小;
(b)酸、碱混合时,把量筒中的NaOH溶液缓缓倒入小烧杯中,会使一部分热量散失,最高温度偏低,使测得的△H数值偏小;
故答案为:偏小;
(c) 实验中用环形铜丝搅拌棒代替代替环形玻璃搅拌棒,金属的导热性很好,会导致热量的散失,最高温度偏低,使测得的△H数值偏小;
故答案为:环形玻璃搅拌棒;偏小;
点评:本题考查反应热的计算、中和热的测定知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
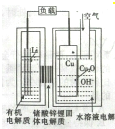 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A、放电时,Li+透过固体电解质向Cu极移动 |
| B、放电时,负极的电极反应式为CuO+H2O+2e---Cu+2OH- |
| C、通空气时,铜被腐蚀,表面产生Cu2O |
| D、整个反应过程中,铜相当于催化剂 |
设NA 表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA |
| B、常温常压下,18 g H2O 中含有的原子总数为3NA |
| C、1 L 0.1 mol?L-1NaHCO3液含有0.1NA个HCO3- |
| D、常温常压下,2.24 L CO 和CO2 混合气体中含有的碳原子数目为0.1NA |
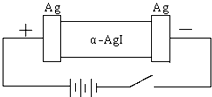 某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.已知铅蓄电池总反应:Pb+PbO2+2H2SO4
某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.已知铅蓄电池总反应:Pb+PbO2+2H2SO4