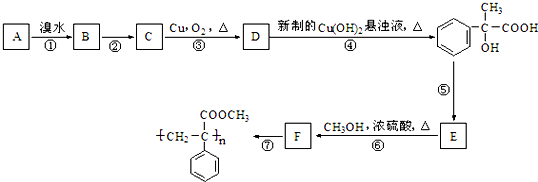
题目内容
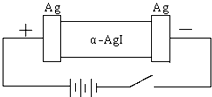 某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.已知铅蓄电池总反应:Pb+PbO2+2H2SO4
某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.已知铅蓄电池总反应:Pb+PbO2+2H2SO4 | 放电 |
| 充电 |
(1)该电解池的阳极电极方程式:
(2)若Ag+导电,α-AgI本身质量将
若I-导电,阳极附近的α-AgI晶体密度将会
(2)若通电一段时间后铅蓄电池中消耗了1molH2SO4,则电解池的阴极增重
考点:原电池和电解池的工作原理
专题:
分析:(1)阳极上Ag失电子发生氧化反应;铅蓄电池正极上PbO2得电子发生还原反应;
(2)若Ag+导电,该装置相当于电镀池;若是碘离子导电,固体密度减小.
(3)根据转移电子相等进行计算.
(2)若Ag+导电,该装置相当于电镀池;若是碘离子导电,固体密度减小.
(3)根据转移电子相等进行计算.
解答:
解:(1)阳极上Ag失电子发生氧化反应,电极反应式为Ag-e-═Ag+,铅蓄电池正极上PbO2得电子发生还原反应,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,
故答案为:Ag-e-═Ag+;PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(2)若Ag+导电,该装置相当于电镀池,阳极溶解的Ag和阴极析出的Ag质量相等,所以α-AgI本身质量将不变,若是碘离子导电,固体密度减小.
故答案为:不变;减小;
(3)若通电一段时间后铅蓄电池中消耗了1molH2SO4,转移电子的物质的量=
×2
×108g/mol=1mol,串联电路中转移电子相等,当转移1mol电子时析出m(Ag)=
×108g/mol=108g,故答案为:108.
故答案为:Ag-e-═Ag+;PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(2)若Ag+导电,该装置相当于电镀池,阳极溶解的Ag和阴极析出的Ag质量相等,所以α-AgI本身质量将不变,若是碘离子导电,固体密度减小.
故答案为:不变;减小;
(3)若通电一段时间后铅蓄电池中消耗了1molH2SO4,转移电子的物质的量=
| 1mol |
| 2 |
| 1mol |
| 1 |
| 1mol |
| 1 |
点评:本题考查了原电池和电解池原理,会根据各个电极上发生的反应书写电极反应式,再结合转移电子相等进行计算,题目难度不大.

练习册系列答案
相关题目
 铝表面空气中天然形成的氧化膜耐磨性和抗蚀性不够强,控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬的氧化膜.下列有关叙述正确的是( )
铝表面空气中天然形成的氧化膜耐磨性和抗蚀性不够强,控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬的氧化膜.下列有关叙述正确的是( )| A、阴极上有金属铝生成 |
| B、电极A为石墨,电极B为金属铝 |
| C、OH-在电极A上放电,有氧气生成 |
| D、阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+ |
下列物质的分类正确的一组是( )
| A、单质:水银、石墨、氦气、HD |
| B、氧化物:金刚砂、Na2O2、双氧水、N2O4 |
| C、混合物:水玻璃、盐酸、胆矾、AgI胶体 |
| D、盐:碱式碳酸铜、小苏打、KI,Ba(OH)2 |