题目内容
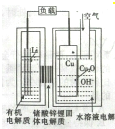 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A、放电时,Li+透过固体电解质向Cu极移动 |
| B、放电时,负极的电极反应式为CuO+H2O+2e---Cu+2OH- |
| C、通空气时,铜被腐蚀,表面产生Cu2O |
| D、整个反应过程中,铜相当于催化剂 |
考点:化学电源新型电池
专题:电化学专题
分析:放电时,锂失电子作负极,Cu上O2得电子作正极,负极上电极反应式为Li-e-═Li+,正极上电极反应式为O2+4e-+2H2O=4OH-,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此分析解答.
解答:
解:A.放电时,阳离子向正极移动,则Li+透过固体电解质向Cu极移动,故A正确;
B.放电时,负极的电极反应式为Li-e-═Li+,故B错误;
C.放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,可知通空气时,铜被腐蚀,表面产生Cu2O,故C正确;
D.通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,故D正确;
故选B.
B.放电时,负极的电极反应式为Li-e-═Li+,故B错误;
C.放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,可知通空气时,铜被腐蚀,表面产生Cu2O,故C正确;
D.通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,故D正确;
故选B.
点评:本题考查了原电池原理,明确原电池负极上得失电子及电极反应式是解本题关键,题目难度中等,注意把握Cu在整个过程中的作用.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
下列事实不能说明醋酸为弱酸的是( )
| A、稀醋酸溶液的导电性比较弱 |
| B、向CH3COONa溶液中滴入酚酞试液,溶液变红色 |
| C、一定温度下,向某醋酸溶液中加入CH3COONH4晶体,溶液pH增大 |
| D、一定温度下,向体积相同,pH值也相同的盐酸和醋酸中,投入相同质量的锌粒,锌粒完全溶解所消耗的时间不同 |
已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时的体积相同.发生反应:2NO2?N2O4一段时间后相继达到平衡状态.下列说法正确的是( )
| A、平衡时NO2的体积分数:甲>乙 |
| B、达到平衡所需要时间,甲比乙多 |
| C、平衡时的颜色,甲比乙深 |
| D、平衡时的平均相对分子质量:甲<乙 |
 铝表面空气中天然形成的氧化膜耐磨性和抗蚀性不够强,控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬的氧化膜.下列有关叙述正确的是( )
铝表面空气中天然形成的氧化膜耐磨性和抗蚀性不够强,控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬的氧化膜.下列有关叙述正确的是( )| A、阴极上有金属铝生成 |
| B、电极A为石墨,电极B为金属铝 |
| C、OH-在电极A上放电,有氧气生成 |
| D、阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+ |
下列说法或表示法错误的是( )
| A、化学反应过程中的能量变化除了热能外,还可以是光能、电能等 |
| B、放热反应的△H<0 |
| C、需要加热才能发生反应一定是吸热反应 |
| D、热化学方程式中的化学计量数仅表示该物质的物质的量,可以是分数 |
一只盛有CO、O2、N2混合气体的气球放在空气(空气平均摩尔质量为29g/mol)中静止不动,则混合气体中O2的体积分数是( )
| A、75% | B、25% |
| C、50% | D、无法计算 |
 近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致.钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致.钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3