题目内容
在100mL 1.0mol/L的Na2SO4溶液中,Na+的物质的量浓度为 SO42-的物质的量浓度为 ,溶质Na2SO4的质量为 .
考点:物质的量浓度的相关计算
专题:计算题
分析:根据Na2SO4的化学式可知,Na2SO4中Na+的物质的量或浓度是Na2SO4的物质的量或浓度的2倍;SO42-的物质的量或浓度与Na2SO4的物质的量或浓度相等;根据n=CV计算出Na2SO4的物质的量,然后根据m=nM来计算质量.
解答:
解:根据Na2SO4的化学式可知,Na2SO4中Na+的浓度是Na2SO4的浓度的2倍,故1.0mol/L的Na2SO4溶液中,Na+的物质的量浓度为2mol/L;
SO42-的浓度与Na2SO4的浓度相等,故SO42-的物质的量浓度为1mol/L;
Na2SO4的物质的量n=CV=1mol/L×0.1L=0.1mol,质量m=nM=0.1mol×142g/mol=14.2g
故答案为:2mol/L,1mol/L,14.2g.
SO42-的浓度与Na2SO4的浓度相等,故SO42-的物质的量浓度为1mol/L;
Na2SO4的物质的量n=CV=1mol/L×0.1L=0.1mol,质量m=nM=0.1mol×142g/mol=14.2g
故答案为:2mol/L,1mol/L,14.2g.
点评:本题考查物质的量浓度计算,比较基础,侧重对基础知识的巩固,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
下列有关化学与生活、生产的叙述错误的是( )
| A、因为氮易液化,液氮在气化时会吸收大量的热量,所以液氮可作制冷剂 |
| B、盐卤点豆腐,明矾净水与胶体的性质有关 |
| C、H2O2、SO2、O3等都用于织物漂白,它们的漂白原理相同 |
| D、硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药 |
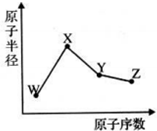 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强,下列说法正确的是( )| A、对应气态氢化物的稳定性Y>Z |
| B、化合物XZW既含离子键也含共价键 |
| C、对应简单离子半径W<X |
| D、Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
质量百分比浓度分别为80%和20%的硫酸溶液等体积混合,混合溶液的质量百分比浓度为( )
| A、>50% | B、=50% |
| C、<50% | D、无法计算 |
将下列物质按酸、碱、盐分类排列,正确的是( )
| A、硝酸、纯碱、石膏 |
| B、硫酸、烧碱、小苏打 |
| C、盐酸、乙醇、氯化钠 |
| D、醋酸、食盐、石灰石 |
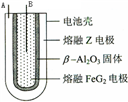 X、Y、Z、M、G五种元素分属三个短周期,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题: 有 X、Y、Z、W四种元素,其中X是周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
有 X、Y、Z、W四种元素,其中X是周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题: