��Ŀ����
10�������ǵ����ʴ�л�IJ��Ҳ����Ҫ�Ļ�ѧ���ϣ���ҵ�ϳ����ط�Ӧ���£�2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��g��
��1����һ����պ����ܱ������г���CO2��NH3����������Ӧ�ϳ����أ��㶨�¶��»�������еİ���������ͼ1��ʾ��
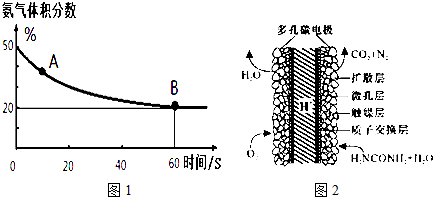
A�������Ӧ����v����CO2������B����淴Ӧ����v�棨CO2�������������������=������������ƽ��ת����Ϊ75%��
��2������������Ǻϳ����ص�һ���м����������Ϊ2��1��NH3��CO2����������һ���ݻ����������ܱ������У��ں㶨�¶���ʹ�䷢�����з�Ӧ���ﵽƽ�⣺2NH3��g��+CO2��g���TNH2COONH4��s����ʵ���õIJ�ͬ�¶��µ�ƽ���������ڱ���
| �¶ȣ��棩 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ��������Ũ�� ��10-3mol/L�� | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A����H��0����S��0B����H��0����S��0 C����H��0����S��0D����H��0����S��0
�ڹ���������Ӧ��ƽ��״̬����˵����ȷ����C
A������������İ�������泥���Ӧ���ת���ʽ�����
B��ƽ��ʱ������ϵ�¶ȣ�CO2����������½�
C��NH3��ת����ʼ�յ���CO2��ת����
D��������Ч�Ĵ����ܹ���߰�������淋IJ���
�۰�������識���ˮ���̼��泥���������ˮ������ף�����������立�ĩ����1L0.1mol/L��������Һ��ֱ��pH=7�������£�������Һ����仯��������ȥ0.052mol��������泥���ʱ��Һ�м�������̼Ԫ�أ�
��ʱ��Һ��c��NH4+��=0.1mol/L�����������ֵ��NH4+ˮ��ƽ�ⳣ��ֵΪ4��10-9��
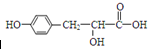
��3����ѧ�������о����ض���ȼ�ϵ�أ���ҺҲ�ܷ��磡�����ֵ��ֱ��ȥ�����з�ˮ�е����أ����ܲ���������ˮ���ܷ��磮����ȼ�ϵ�ؽṹ��ͼ2��ʾ��д���õ�صĸ�����Ӧʽ��CO��NH2��2+H2O-6e-=CO2+N2+6H+��
���� ��1��ͼ��������������������50%�仯Ϊ20%������������ֲ��䣬˵��B�㷴Ӧ�ﵽƽ��״̬��A�㰱������ٷֺ�������B�İ�������ٷֺ�����˵����Ӧ������дﵽƽ��״̬��A�������Ӧ���ʴ���B�������Ӧ���ʣ����ݰ���������������ƽ������ʽ��ʽ����ƽ��ת���ʣ�
��2���ٸ��ݱ��е����ݷ������¶�Խ�ߣ���ƽ���������Ũ��Խ�����������¶ȣ�ƽ�������ƶ�������Ӧ��Ӧ�Ƿ��ȷ�Ӧ��
��Ӧ�������壬�����ǹ��壬�÷�Ӧ���ؼ�С�Ĺ��̣�
��A����Ϊ���������Ϊ���壬����������İ�������泥�ƽ�ⲻ�ƶ���
B�����������Ϊ���壬����NH3��CO2ʼ��Ϊ2��1��
C����Ϊ�����Ϊ2��1��NH3��CO2���������뷴Ӧ��NH3��CO2�ְ���2��1�����ģ�����NH3��ת����ʼ�յ���CO2��ת���ʣ�
D������ֻ�ı����ʣ����ı�ƽ���ƶ����ɴ˽����жϣ�
�۸��ݰ�������識���ˮ���̼��泥�����ӦʽΪNH2COONH4��s��+H2O?��NH4��2CO3������������立�ĩ����1L0.1mol/L��������Һ��ֱ��pH=7������Һ�м�������̼Ԫ�أ�������Һ��ֻ��H+��NH4+��OH-��Cl-�����ݵ���غ����c��NH4+��������NH4++H2O?NH3•H2O+OH-���K=$\frac{c��N{H}_{3}•{H}_{2}O��•c��{H}^{+}��}{c��N{{H}_{4}}^{+}��}$���м��㣻
��3������ȼ�ϵ���������ٸ�����ʧȥ�������ɵ�����������̼��
��� �⣺��1�����������������50%�仯Ϊ20%������������ֲ��䣬˵��B�㷴Ӧ�ﵽƽ��״̬��A�㰱������ٷֺ�������B�İ�������ٷֺ�����˵����Ӧ������дﵽƽ��״̬��A�������Ӧ���ʴ���B�������Ӧ���ʣ���v����CO2����v����CO2����
�谱���������ʵ���x����ʼ�����������Ϊ50%�����谱��Ϊ50mol��������̼Ϊ50mol��
CO2+2NH3?��NH2��2CO+H2O
��ʼ����mol�� 50 50 0 0
�仯����mol�� 0.5x x 0.5x 0.5x
ƽ������mol�� 50-0.5x 50-x 0.5x 0.5x
�������������=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%����ã�x=37.5mol��
������ƽ��ת����=$\frac{37.5mol}{50mol}$��100%=75%��
�ʴ�Ϊ������75%��
��2���ٸ��ݱ��е����ݷ������¶�Խ�ߣ���ƽ���������Ũ��Խ�����������¶ȣ�ƽ�������ƶ�������Ӧ��Ӧ�Ƿ��ȷ�Ӧ���ʡ�H��0��
��Ӧ�������壬�����ǹ��壬�÷�Ӧ���ؼ�С�Ĺ��̣�������S��0��
�ʴ�Ϊ��A��
��A����Ϊ���������Ϊ���壬����������İ�������泥�ƽ�ⲻ�ƶ������Է�Ӧ���ת���ʲ��䣬��A����
B��ƽ��ʱ������ϵ�¶ȣ�ƽ������ȷ�������Ӧ�����ƶ����ְ��������Ϊ���壬����NH3��CO2ʼ��Ϊ2��1����CO2������������䣬��B����
C����Ϊ�����Ϊ2��1��NH3��CO2���������뷴Ӧ��NH3��CO2�ְ���2��1�����ģ�����NH3��ת����ʼ�յ���CO2��ת���ʣ���C��ȷ��
D������ֻ�ı����ʣ����ı�ƽ���ƶ������Լ�����Ч�Ĵ������ܹ���߰�������淋IJ��ʣ���D����
�ʴ�Ϊ��C��
����Ϊ��������識���ˮ���̼��泥�����ӦʽΪNH2COONH4��s��+H2O?��NH4��2CO3������1L0.1mol/L��������Һ��ֱ����ҺpH=7������Һ�м�������̼Ԫ�أ�������Һ��ֻ��H+��NH4+��OH-��Cl-�����ݵ���غ�c��NH4+��=c��Cl-��=0.1mol/L������ȥ0.052mol��������泥����Կ�ʼ��Һ�е�笠�����Ũ��Ϊ0.052mol/L��2=0.104mol/L��
NH4++H2O?NH3•H2O+H+��
��ʼ 0.104mol/L 0
ת�� 0.004mol/L 0.004mol/L
ƽ�� 0.1mol/L 0.004mol/L
����ҺΪpH=7������������Ũ��Ϊ10-7mol/L����NH4+ˮ��ƽ�ⳣ��K=$\frac{c��N{H}_{3}•{H}_{2}O��•c��{H}^{+}��}{c��N{{H}_{4}}^{+}��}$=$\frac{0.004��1{0}^{-7}}{0.1}$=4��10-9��
�ʴ�Ϊ��0.1mol/L��4��10-9��
��3������ȼ�ϵ���������ٸ�����ʧȥ�������ɵ�����������̼������ӦΪ��CO��NH2��2+H2O-6e-�TN2��+CO2��+6H+��
�ʴ�Ϊ��CO��NH2��2+H2O-6e-�TN2��+CO2��+6H+��
���� ���⿼�黯ѧƽ����㡢��ѧ��Ӧ���ʡ���ѧƽ����ƶ�ԭ�����������������Һ�е�ˮ��ƽ��ļ���Ӧ���Լ�ȼ�ϵ�ظ�����Ӧʽ����д��֪ʶ����Ŀ�Ѷ��еȣ������ۺ��Խϴ�ֿ�����ѧ���ķ������������Ӧ��������

 ��˵���У���ȷ���ǣ�������
��˵���У���ȷ���ǣ�������| A�� | �ں˴Ź������������������շ� | |
| B�� | �� ��Ϊͬ���칹�� ��Ϊͬ���칹�� | |
| C�� | 1mol ���л�����NaOH��Һ��Ӧ���������3mol NaOH | |
| D�� | ���Է���ȡ����Ӧ���ӳɷ�Ӧ����ȥ��Ӧ�����۷�Ӧ |
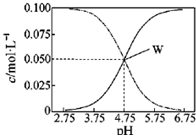 25�棬��c��CH3COOH��+c��CH3COO-��=0��l mol/L��һ�����ʹ����ƻ����Һ����Һ��c��CH3COOH����c��CH3COO-����pHֵ�Ĺ�ϵ��ͼ��ʾ���й�����Ũ�ȹ�ϵ������ȷ���ǣ�������
25�棬��c��CH3COOH��+c��CH3COO-��=0��l mol/L��һ�����ʹ����ƻ����Һ����Һ��c��CH3COOH����c��CH3COO-����pHֵ�Ĺ�ϵ��ͼ��ʾ���й�����Ũ�ȹ�ϵ������ȷ���ǣ�������| A�� | pH=5.5��Һ�У�c��CH3COO-��c��CH3COOH����c��H+����c��OHһ�� | |
| B�� | W���ʾ��Һ�У�c��Na+��=c��CH3COO-�� | |
| C�� | pH=3.5��Һ�У�c��Na+��-c��OH-��+c��CH3COOH��=0��l moL/L | |
| D�� | ��W������ʾ��Һ��ͨ��0.05molHCl���壨��Һ����仯�ɺ��ԣ���c��H+��=c��CH3COOH��+c��OH-�� |
| A�� | 23gNa������H2O��Ӧ��ȫ��ʧȥ2NA������ | |
| B�� | 1molCu��������Ũ���ᷴӦ������NA��SO3���� | |
| C�� | ��״���£�22.4LN2��H2������к�2NA��ԭ�� | |
| D�� | 3mol����Fe��ȫת��ΪFe3O4��ʧȥ9NA������ |
| A�� | 2�� | B�� | 5�� | C�� | 6�� | D�� | 8�� |
| ������ | CaF2 | CaC2O4 |
| Ksp | 3.5��10-11 | 2.3��10-9 |
| �� | HF | H2C2O4 |
| ���볣�� | Ka=7.2��10-4 | Ka1=5.4��10-2 Ka2=5.4��10-5 |
��2����0.1mol•L-1�IJ��������Һ�еμ�NaOH��Һ����Һ�����ԣ���ʱ��Һ�и����ӵ�Ũ�ȹ�ϵ��ȷ����ad������ĸ����
a��c��K+��=c��HC2O4-��+c��H2C2O4��+c��C2O42-��
b��c��K+��+c��Na+��=c��HC2O4-��+c��C2O42-��
c��cNa+��=c��H2C2O4��+c��C2O42-��
d��c��K+����cNa+��
��3����Ũ��Ϊ1mol•L-1��HF��0.01mol•L-1��KHC2O4-�����Һ����μ���1mol•L-1��CaCl2��Һ������õ��ij���ΪCaF2���ѧʽ����
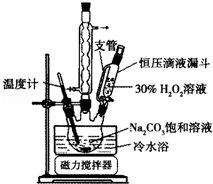 2Na2CO3•3H2O2��һ�����͵���ϵƯ����ijʵ����ȤС�����������ʵ�飮
2Na2CO3•3H2O2��һ�����͵���ϵƯ����ijʵ����ȤС�����������ʵ�飮


