题目内容
1. 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.Ⅰ.实验制备
实验原理:2Na2CO3+3H2O2=2Na2CO3•3H2O2
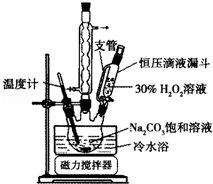
实验步骤:取3.5g Na2CO3溶于10mL H2O,加入0.1g稳定剂,用磁力搅拌器搅拌完全溶解后,将6.0mL 30%H2O2在15min内缓慢加入到三颈烧瓶中,实验装置如图.反应1小时后,加入1g氯化钠后,静置结晶,然后抽滤,干燥一周后,称重.
(1)装置中球形冷凝管的作用是起冷凝回流的作用,使用冷水浴的作用是防止温度过高,H2O2分解.
(2)加入适量NaCl固体的原因是降低产品的溶解度(盐析作用)或便于析出晶体.
(3)2Na2CO3•3H2O2极易分解,其分解反应方程式可表示为2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑.
Ⅱ.活性氧含量测定
准确称取试样0.2000g,置于250mL锥形瓶中,加100mL浓度为6%的硫酸溶液,用0.0200mol/L KMnO4标准溶液滴定,记录KMnO4标准溶液消耗的体积为32.70mL.
活性氧含量计算公式:Q%=(40cV/m)×100%
[c:KMnO4标准溶液浓度(mol/L);V:消耗的KMnO4标准溶液体积(L);m:试样质量(g)]
(4)滴定终点的判断依据为溶液由无色呈紫色且30s内不褪色,活性氧含量为13.08%.
Ⅲ.产品纯度的测定
(5)为了测定产品中2Na2CO3•3H2O2的质量分数,设计了几种方案,涉及不同的反应原理.
方案一:将试样与MnO2混合均匀,向混合物中滴加水,测生成气体的体积,进而进行计算.
方案二:将试样与足量的氯化钡(或氯化钙等)溶液反应后,过滤,干燥所得沉淀,称量沉淀的质量(或试样与足量稀硫酸反应后,经除杂干燥后,测二氧化碳的体积,进行计算)..
分析 Ⅰ.(1)球形冷凝管可使液体冷凝回流;冷水浴降低温度,防止物质分解;
(2)加入适量NaCl固体,发生盐析;
(3)2Na2CO3•3H2O2极易分解,生成碳酸钠、氧气、水;
Ⅱ.(4)高锰酸钾标准溶液为紫色,与过氧化氢发生氧化还原反应;活性氧含量计算公式:Q%=$\frac{40cV}{m}$×100%,以此计算;
Ⅲ.(5)方案中可测定过氧化氢分解生成的氧气,或测定碳酸根离子转化生成的沉淀或气体来测定产品中2Na2CO3•3H2O2的质量分数.
解答 解:Ⅰ.(1)装置中球形冷凝管的作用是起冷凝回流的作用,过氧化氢不稳定,则使用冷水浴的作用是防止温度过高,H2O2分解,
故答案为:起冷凝回流的作用,防止温度过高,H2O2分解;
(2)加入适量NaCl固体,降低产品的溶解度(盐析作用)或便于析出晶体,故答案为:降低产品的溶解度(盐析作用)或便于析出晶体;
(3)2Na2CO3•3H2O2极易分解,生成碳酸钠、氧气、水,反应方程式为2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑,
故答案为:2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑;
Ⅱ.(4)高锰酸钾标准溶液为紫色,能与过氧化氢发生氧化还原反应,高锰酸钾标准溶液滴定2Na2CO3•3H2O2,则滴定终点的判断依据为溶液由无色呈紫色且30s内不褪色,0.0200mol/L高锰酸钾标准溶液消耗的体积为32.70mL,试样0.2000g,活性氧含量为Q%=$\frac{40cV}{m}$×100%=$\frac{40×0.020mol/L×0.03270L}{0.200g}$×100%=13.08%,
故答案为:溶液由无色呈紫色且30s内不褪色,13.08%;
Ⅲ.(5)方案中可测定过氧化氢分解生成的氧气,或测定碳酸根离子转化生成的沉淀(或气体体积)质量测定产品中2Na2CO3•3H2O2的质量分数,则方案二为将试样与足量的氯化钡(或氯化钙等)溶液反应后,过滤,干燥所得沉淀,称量沉淀的质量(或试样与足量稀硫酸反应后,经除杂干燥后,测二氧化碳的体积,进行计算),
故答案为:将试样与足量的氯化钡(或氯化钙等)溶液反应后,过滤,干燥所得沉淀,称量沉淀的质量(或试样与足量稀硫酸反应后,经除杂干燥后,测二氧化碳的体积,进行计算).
点评 本题考查制备实验方案的设计,为高频考点,把握实验基本操作、实验技能及测定原理、发生的反应等为解答的关键,侧重分析与实验能力的考查,题目难度中等.

| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
(1)A是CH3COONa,B是NH4Cl(填化学式).
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓.
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(4)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.00125mol•L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:4.
| A. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为a/2kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l);△H1=-akJ•mol-1,则氢气燃烧热为akJ•mol-1 | |
| C. | 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 | |
| D. | N2(g)+3H2(g)?2NH3(g);△H=-akJ•mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 石英可用于制作光导纤维,光导纤维遇强碱会“断路” | |
| C. | 清晨阳光穿过林木枝叶铺洒地面属于丁达尔现象 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
| A. | 某H2S04溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×l0-8,由水电离出的c(H+)=1×10-11 mol•L-1 | |
| B. | 将0.02 mol.L-1 HCI溶液与0.02 mol•L-l Ba( OH)2溶液等体积混合后,溶液pH约为12 | |
| C. | 将一定体积稀盐酸与稀氨水混合,当溶质为NH3•H20和NH4Cl时,溶液的pH≥7 | |
| D. | 向0.1 mol•L-1 Na2C03溶液中逐滴滴加0.1 mol•L-1稀盐酸,溶液中c(HCO3-)先增大后减小 |
| A. | NH4+、SO42-、CO32-、K+ | B. | Na+、Ba2+、Ca2+、HCO3- | ||
| C. | Mg2+、Ag+、K+、Cl- | D. | K+、Cl-、Na+、SO42- |
 图是2008年北京奥运会的“祥云”火炬,与悉尼奥运火炬所用主要燃料(丁烷)不同,“祥云”火炬所用燃料为丙烷.丙烷和丁烷的沸点如下表:
图是2008年北京奥运会的“祥云”火炬,与悉尼奥运火炬所用主要燃料(丁烷)不同,“祥云”火炬所用燃料为丙烷.丙烷和丁烷的沸点如下表:| 丙烷 | 丁烷 | |
| 沸点/℃ | -42.6 | -0.5 |
| A. | 丙烷燃烧生成的产物无害,是环保型燃料 | |
| B. | 丙烷的沸点比丁烷低,是因为分子间作用力比丁烷弱 | |
| C. | 丙烷在低温时保持的压力比丁烷大 | |
| D. | 丙烷和丁烷都不存在同分异构体 |
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.
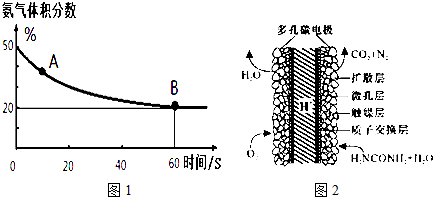
A点的正反应速率v正(CO2)大于B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)将实验测得的不同温度下的平衡数据列于表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;(填具体数值)NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.