题目内容
19. 过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下方案:
过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下方案:方案一:取m1g样品,加入 足量的CaCl2溶液,充分反应后过滤、洗涤、干燥,测得CaCO3沉淀质量为m2g;
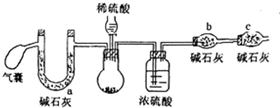
方案二:取m1g样品,用如下装置测得生成二氧化碳质量为m3g;
方案三:取m1g样品,加水充分溶解并微热至不再产生气体,用cmol/L的盐酸标准溶液滴定所得溶液(甲基橙作指示剂),终点时消耗盐酸的体积为VmL.
回答下列问题:
(1)方案一中,经正确操作后,测得的过氧化钠的纯度比实际的偏低,其原因是生成微溶的Ca(OH)2,致使m2数值偏大;
(2)方案二中气囊要使用两次,第二次使用的目的是排出装置中生成的CO2完全被碱石灰吸收,C干燥管的作用是防止空气中水和二氧化碳进入b中,若用稀盐酸代替稀硫酸,则测定结果偏低(填“高”、“低”或“不影响”)
(3)方案三中,滴定终点的现象是溶液由黄色变成橙色,且半分钟内不变黄,测得过氧化钠的纯度为$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%.(用含m1、c、V的式子表示)
(4)某小组同学向过氧化钠与水反应的溶液中滴加酚酞,发现溶液先变红后褪色,针对导致溶液褪色的原因提出两种假设:
假设一:因氢氧化钠溶液的浓度过大而使溶液褪色
假设二:因生成了过氧化氢而使溶液褪色
…
实验验证:向等体积浓度分别为5mol•L-1,2mol•L-1,1mol•L-1,0.01mol•L-1的氢氧化钠溶液中滴加酚酞试液,观察到溶液变红后褪色的时间如下:
| 氢氧化钠浓度(mol•L-1) | 5 | 2 | 1 | 0.01 |
| 变红后褪色的时间(s) | 8 | 94 | 450 | 长时间不褪色 |
设计实验验证假设二取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立.
分析 (1)反应中会生成微弱的氢氧化钙,导致测定碳酸钙测定质量偏大;
(2)圆底烧瓶中生成二氧化碳,用浓硫酸干燥二氧化硫,干燥管b中碱石灰吸收二氧化碳,根据干燥管b质量增大可知二氧化碳的质量,进而计算样品中碳酸钠的质量,可得过氧化钠的纯度,干燥管c吸收空气中水蒸气与二氧化碳,防止加入b中,开始利用气囊鼓入空气排尽装置中空气,用a装置吸收鼓入空气中二氧化碳与水蒸气,结束后再排出装置中二氧化碳进入b中被完全吸收;
若利用与水代替稀硫酸,挥发出的HCl会被b中碱石灰吸收,测定二氧化碳的质量偏大;
(3)滴定终点落在指示剂的变色范围之内,终点时溶液用颜色由黄色变为橙红色;计算消耗HCl的物质的量,反应生成NaCl,根据离子守恒可知过氧化钠、碳酸钠中钠离子总物质的量,再结合质量列方程计算;
(4)由表中数据可知,酚酞在浓的NaOH溶液中先变红后褪色,且碱浓度越大、褪色越快;
若由于生成过氧化氢使溶液红色褪去,可以加入二氧化锰使之分解,再加入酚酞溶液,与直接加入酚酞溶液进行对比验证.
解答 解:(1)反应中会生成微弱的氢氧化钙,导致测定碳酸钙测定质量偏大,计算得到碳酸钠的质量偏大,故测得的过氧化钠的纯度比实际的偏低,
故答案为:生成微溶的Ca(OH)2,致使m2数值偏大;
(2)圆底烧瓶中生成二氧化碳,用浓硫酸干燥二氧化硫,干燥管b中碱石灰吸收二氧化碳,根据干燥管b质量增大可知二氧化碳的质量,进而计算样品中碳酸钠的质量,可得过氧化钠的纯度,干燥管c吸收空气中水蒸气与二氧化碳,防止加入b中,开始利用气囊鼓入空气排尽装置中空气,用a装置吸收鼓入空气中二氧化碳与水蒸气,结束后再排出装置中二氧化碳进入b中被完全吸收;
若利用与水代替稀硫酸,挥发出的HCl会被b中碱石灰吸收,测定二氧化碳的质量偏大,计算碳酸钠的质量偏大,故沉淀过氧化钠的纯度偏低,
故答案为:排出装置中生成的CO2完全被碱石灰吸收;防止空气中水和二氧化碳进入b中;低;
(3)滴定终点落在指示剂的变色范围之内,终点时溶液由黄色变成橙色,且半分钟内不变黄,
消耗HCl的物质的量为0.001V L×c mol/L=0.001Vc mol,则生成NaCl为0.001Vc mol,
设过氧化钠、碳酸钠物质的量分别为xmol、ymol,则:
由钠离子守恒:2x+2y=0.001Vc
根据二者总质量:78x+106y=m1
解得x=$\frac{0.053Vc-{m}_{1}}{28}$,
则过氧化钠的含量为$\frac{\frac{0.053Vc-{m}_{1}}{28}mol×78g/mol}{{m}_{1}}$×100%=$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%,
故答案为:溶液由黄色变成橙色,且半分钟内不变黄;$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%;
(4)由表中数据可知,酚酞在浓的NaOH溶液中先变红后褪色,且碱浓度越大、褪色越快;
若由于生成过氧化氢使溶液红色褪去,可以加入二氧化锰使之分解,再加入酚酞溶液,与直接加入酚酞溶液进行对比验证,验证假设二的实验方案为:取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立,
故答案为:酚酞在浓的NaOH溶液中先变红后褪色,且碱浓度越大、褪色越快;
取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立.
点评 本题考查物质含量测定实验、物质性质探究实验及实验方案设计等,(3)中含量表达式为易错点,较好地考查学生对原理的理解与分析计算能力.

Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2mol•L-1 H2SO4溶液和10mL 20% NH4Fe(SO4)2•12H2O溶液,摇匀,小火加热蒸发至碘完全挥发,取下锥形瓶冷却后,加入10mL 2mol•L-1 H2SO4溶液,加入几滴二苯胺磺酸钠(用作指示剂),用0.025 0mol•L-1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录见下表:(已知反应:
①2Fe3++2I-═2Fe2++I2 ②6Fe2++Cr2O${\;}_{7}^{2-}$+14H+═6Fe3++2Cr3++7H2O)
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.60 | 19.65 | 19.55 |
取250mL含碘废液于烧杯中,加入Na2S2O3溶液,并将饱和CuSO4溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应生成CuI沉淀.过滤,得到的CuI沉淀按图1进行操作,检查装置的气密性后,从分液漏斗中逐滴加浓硝酸(注意滴液的速度),完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液,然后按图2进行粗碘的提纯.
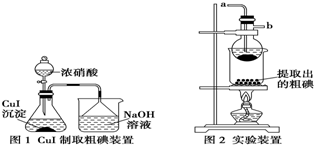
请回答下列问题:
(1)简述图2实验装置中烧瓶的作用升华分离冷凝回收碘.
(2)某同学欲配制200mL 2mol•L-1的H2SO4,配制方法合理的是C.
A.在200mL 1mol•L-1的H2SO4中加入22.4L标准状况下的SO3
B.向100mL 4mol•L-1的H2SO4中加入100mL水
C.取5mol•L-1的H2SO4 80.0mL,加水至200mL
D.将16g NaOH固体加入到200mL 3mol•L-1的H2SO4溶液中
(3)在盛有废液的锥形瓶中先加入5mL 2mol•L-1H2SO4的目的是加热蒸发碘时可有效抑制Fe3+水解,使后续测定结果更准确.
(4)根据滴定的有关数据,计算该废液中I-的含量为14.94g•L-1(保留小数点后两位).
(5)写出图1锥形瓶中发生反应的化学方程式:2CuI+8HNO3=2Cu(NO3)2+NO2↑+I2+4H2O.
(6)按图2装置进行粗碘提纯,采用的分离方法是升华,a、b为冷凝水进出口,其中a(填“a”或“b”)接水龙头,最终能得到较多较高纯度的单质碘.
| A. | 15 种 | B. | 16 种 | C. | 17 种 | D. | 18 种 |

 中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注.
中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注. ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
 ,它是极性(填“极性”或“非极性”)键形成的非极性分子.
,它是极性(填“极性”或“非极性”)键形成的非极性分子.