题目内容
将24 mL NO、NO2的混合气体通入倒立于水槽中盛满水的量筒内,然后再向其中通入12mL O2,充分反应后,量筒内剩余气体体积为3mL,在相同状况下,原混合气体中NO,NO2的体积各是多少ml?
考点:有关混合物反应的计算
专题:计算题
分析:二氧化氮与水反应为:3NO2+H2O═2HNO3+NO,将24 mL NO、NO2的混合气体通入倒立于水槽中盛满水的量筒内,得到的为NO气体,然后通入氧气,发生反应:4NO+3O2+2H2O=4HNO3,最终剩余的气体可能为NO或O2,然后结合题中数据及反应方程式分别进行计算原混合气体中NO,NO2的体积.
解答:
解:将24 mL NO、NO2的混合气体通入倒立于水槽中盛满水的量筒内,发生反应:3NO2+H2O═2HNO3+NO,得到的气体为NO,
然后再向其中通入12mL O2,发生反应:4NO+3O2+2H2O=4HNO3,所以最终剩余的气体可能为:NO或O2,
设24ml的NO、NO2混合气体中两种气体的体积分别为x、y,
①当剩余3ml气体为O2时,反应消耗氧气的体积为:12mL-3mL=9mL,依据4NO+3O2+2H2O=4HNO3可知,二氧化氮与水反应后的NO总体积为:9mL×
=12mL,则:x+y=24、x+
y=12,解得:x=6mL、y=18mL,即:混合气体中NO体积为6mL、二氧化氮体积为18mL;
②当剩余气体为NO时,说明氧气完全反应,依据4NO+3O2+2H2O=4HNO3可知,二氧化氮与水反应后的NO总体积为:3+12mL×
=19mL,则:x+y=24、x+
y=19,解得:x=16.5mL、y=7.5mL,即:混合气体中NO体积为16.5mL、二氧化氮体积为7.5mL,
答:原混合气体中NO体积为6mL时、二氧化氮体积为18mL或NO为16.5mL,NO2的体积为7.5mL.
然后再向其中通入12mL O2,发生反应:4NO+3O2+2H2O=4HNO3,所以最终剩余的气体可能为:NO或O2,
设24ml的NO、NO2混合气体中两种气体的体积分别为x、y,
①当剩余3ml气体为O2时,反应消耗氧气的体积为:12mL-3mL=9mL,依据4NO+3O2+2H2O=4HNO3可知,二氧化氮与水反应后的NO总体积为:9mL×
| 4 |
| 3 |
| 1 |
| 3 |
②当剩余气体为NO时,说明氧气完全反应,依据4NO+3O2+2H2O=4HNO3可知,二氧化氮与水反应后的NO总体积为:3+12mL×
| 4 |
| 3 |
| 1 |
| 3 |
答:原混合气体中NO体积为6mL时、二氧化氮体积为18mL或NO为16.5mL,NO2的体积为7.5mL.
点评:本题考查了有关混合物反应的计算,题目难度中等,明确发生反应原理是解本题关键,注意讨论法在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
A、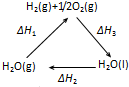 △H1=△H2+△H3 |
B、 在催化剂条件下,反应的活化能等于E1+E2 |
C、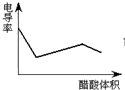 表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 |
D、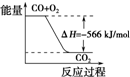 可表示由CO(g)生成CO2(g)的反应过程和能量关系 |
氢氧化钙溶解度随温度的变化如表所示,下列说法错误的是( )
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 | 150 | 200 |
| 溶解度(g/100gH2O) | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.11 | 0.092 | 0.074 | 0.034 | 0.012 |
| A、氢氧化钙的溶解是放热过程 |
| B、100℃时氢氧化钙的Kxp约等于4×10-6 |
| C、温度升高时氢氧化钙溶解速率加快 |
| D、100℃时pH=12的溶液中c(Ca2+)≤0.04mol?L-1 |
0.1mol/LNaOH和0.1mol/LNH4Cl溶液等体积混和后,离子浓度大小顺序正确的是( )
| A、c(Na+)>c(Cl-)>c(OH-)>c(H+) |
| B、c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C、c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| D、c(Cl-)>c(Na+)>c(OH-)>c(H+) |
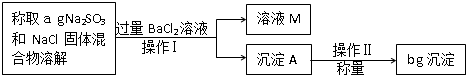
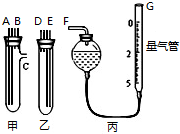 某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案:
某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案: