题目内容
下列说法正确的是( )
A、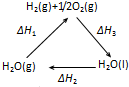 △H1=△H2+△H3 |
B、 在催化剂条件下,反应的活化能等于E1+E2 |
C、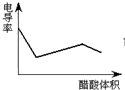 表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 |
D、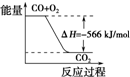 可表示由CO(g)生成CO2(g)的反应过程和能量关系 |
考点:用盖斯定律进行有关反应热的计算,反应热和焓变,弱电解质在水溶液中的电离平衡
专题:图示题
分析:A、根据盖斯定律来分析;
B、催化剂改变了反应历程,E1、E2分别代表各步反应的活化能;
C、醋酸和一水合氨是弱电解质,在溶液里部分电离,氢氧化钠是强电解质,完全电离,向混合溶液中滴加醋酸,醋酸先和氢氧化钠反应生成强电解质醋酸钠,氢氧化钠完全反应后,醋酸再和氨水反应生成强电解质醋酸铵,根据溶液中离子浓度变化与电导率的关系分析解答;
D、未指明是几摩尔CO燃烧放出566KJ的热量.
B、催化剂改变了反应历程,E1、E2分别代表各步反应的活化能;
C、醋酸和一水合氨是弱电解质,在溶液里部分电离,氢氧化钠是强电解质,完全电离,向混合溶液中滴加醋酸,醋酸先和氢氧化钠反应生成强电解质醋酸钠,氢氧化钠完全反应后,醋酸再和氨水反应生成强电解质醋酸铵,根据溶液中离子浓度变化与电导率的关系分析解答;
D、未指明是几摩尔CO燃烧放出566KJ的热量.
解答:
解:A、根据盖斯定律来可知:一个反应无论是一步完成还是分为数步完成,其热效应是相同的,故应有:△H1=-△H2-△H3,故A错误;
B、E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故B错误;
C、氢氧化钠是强电解质,氨水是弱电解质,滴加的弱电解质先和氢氧化钠反应生成强电解质醋酸钠,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氢氧化钠完全被中和后,醋酸继续与弱电解质氨水反应生成强电解质醋酸铵,所以电导率增大;氨水也完全反应后,继续滴加醋酸,因为溶液被稀释,电导率有下降趋势,故C正确;
D、图象中未标明CO、氧气以及CO2的物质的量与焓变的值的数值计量关系,故D错误;
故选C.
B、E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故B错误;
C、氢氧化钠是强电解质,氨水是弱电解质,滴加的弱电解质先和氢氧化钠反应生成强电解质醋酸钠,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氢氧化钠完全被中和后,醋酸继续与弱电解质氨水反应生成强电解质醋酸铵,所以电导率增大;氨水也完全反应后,继续滴加醋酸,因为溶液被稀释,电导率有下降趋势,故C正确;
D、图象中未标明CO、氧气以及CO2的物质的量与焓变的值的数值计量关系,故D错误;
故选C.
点评:本题考查了盖斯定律的应用,活化能概念应用,反应焓变的意义以及溶液的导电性等问题,难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
下列离子方程式正确的是( )
| A、钠和水的反应:Na+H2O=Na++OH-+H2↑ |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| C、铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| D、氢氧化钡溶液跟稀硫酸反应:Ba2++OH-+H++SO42-=BaSO↓+H2O |
短周期元素X、Y、Z在元素周期表中的相对位置所示,其中X原子最外层电子数是次外层电子数的3倍.下列说法错误的是( )
| X | |
| Y | Z |
| A、元素X和元素Y的最高正化合价相同 |
| B、气态氢化物的热稳定性:H2Y<H2X |
| C、Y2Z2是共价化合物 |
| D、酸性:HZO4>H2YO4 |
某有机物的分子式为C8H8O2,含有苯环和-COOH的同分异构体有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
 次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性.
次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性.
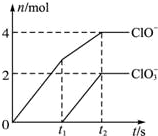 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2═5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2═5CaCl2+Ca(ClO3)2+6H2O.