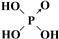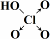题目内容
氢氧化钙溶解度随温度的变化如表所示,下列说法错误的是( )
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 | 150 | 200 |
| 溶解度(g/100gH2O) | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.11 | 0.092 | 0.074 | 0.034 | 0.012 |
| A、氢氧化钙的溶解是放热过程 |
| B、100℃时氢氧化钙的Kxp约等于4×10-6 |
| C、温度升高时氢氧化钙溶解速率加快 |
| D、100℃时pH=12的溶液中c(Ca2+)≤0.04mol?L-1 |
考点:溶解度、饱和溶液的概念
专题:物质的量浓度和溶解度专题
分析:A.根据图象中温度对氢氧化钙的溶解度的影响,可知温度升高,溶解平衡逆向移动;
B.根据溶度积表达式及溶液中钙离子和氢氧根离子的浓度计算;
C.根据温度升高,氢氧化钙溶解在水中的微粒运动速度加快,扩散的更快;
D.根据100℃时的Ksp及溶液中氢氧根离子的浓度计算.
B.根据溶度积表达式及溶液中钙离子和氢氧根离子的浓度计算;
C.根据温度升高,氢氧化钙溶解在水中的微粒运动速度加快,扩散的更快;
D.根据100℃时的Ksp及溶液中氢氧根离子的浓度计算.
解答:
解:A.根据图象可知,升高温度,氢氧化钙的溶解度减小,溶解平衡逆向移动,所以溶解过程是放热过程,故A正确;
B.100℃时氢氧化钙的溶解度为0.074g,氢氧化钙的物质的量为:
=1×10-3mol,100.074g氢氧化钙溶液的体积约为100mL,溶液中钙离子、氢氧根离子离子浓度分别为:1×10-2mol/L,2×10-2mol/L,所以100℃时氢氧化钙的Ksp=c(Ca2+)×c2(OH-)=1×10-2×(2×10-2)2=4×10-6,故B正确;
C.温度升高,氢氧化钙溶解在水中的微粒运动速度加快,扩散的更快,溶解速率加快,故C正确;
D.100℃时pH=12的溶液中,KW=10-12,所以c(OH-)=1mol/L,所以c(Ca2+)≤
=
=4×10-6,故D错误;
故选D.
B.100℃时氢氧化钙的溶解度为0.074g,氢氧化钙的物质的量为:
| 0.074g |
| 74g/mol |
C.温度升高,氢氧化钙溶解在水中的微粒运动速度加快,扩散的更快,溶解速率加快,故C正确;
D.100℃时pH=12的溶液中,KW=10-12,所以c(OH-)=1mol/L,所以c(Ca2+)≤
| Ksp |
| c2(OH-) |
| 4×10-6 |
| 1 |
故选D.
点评:本题考查了难溶物的溶解平衡、溶度积的表达式及计算、题目难度中等,注意掌握难溶物的溶解平衡及其影响因素,明确100℃时pH=12的溶液中KW=10-12是易错点.

练习册系列答案
相关题目
下列有机物用于合成聚乙烯塑料,是聚乙烯的单体的是( )
| A、CH4 |
| B、CH2=CH2 |
| C、CH3CH2OH |
| D、CH2=CHCH3 |
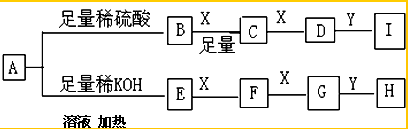
某固体粉末X中可能含有FeO、Fe2O3、MnO2、K2S、K2SO3、KAlO2、MgCl2、K2SO4、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下: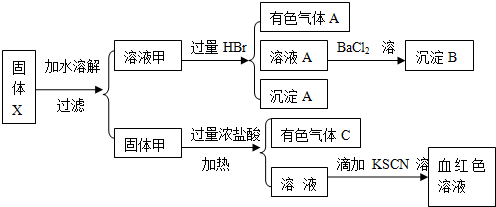 根据上述实验,以下说法正确的是( )
根据上述实验,以下说法正确的是( )
 根据上述实验,以下说法正确的是( )
根据上述实验,以下说法正确的是( )| A、原混合物中一定不含有MgCl2 |
| B、气体A的成分可能超过2种 |
| C、溶液甲中一定含有Na2SiO3、NaNO2、K2SO4可能含有K2CO3、K2SO3 |
| D、固体甲中除MnO2外,可能只含有FeO |
 次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性.
次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性.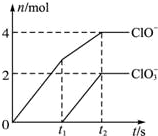 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2═5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2═5CaCl2+Ca(ClO3)2+6H2O.