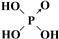题目内容
某工厂的工业废水中含有大量的FeSO4,较多的Cu2+和少量Na+.该工厂计划从废水中回收FeSO4和金属铜.根据下列流程图,回答问题.
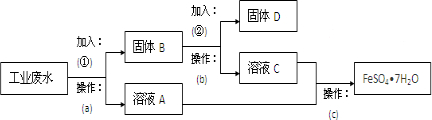
(1)a操作需要用到的玻璃仪器有 .
(2)加入的试剂①为 ,要判断所加试剂①是否过量,其操作方法是 .
(3)加入试剂②发生反应的离子方程式是 .
(4)c操作为 、冷却结晶、 、洗涤、干燥.

(1)a操作需要用到的玻璃仪器有
(2)加入的试剂①为
(3)加入试剂②发生反应的离子方程式是
(4)c操作为
考点:物质分离和提纯的方法和基本操作综合应用,物质的分离、提纯的基本方法选择与应用
专题:
分析:从废水中回收FeSO4和金属铜,由流程可知,先加过量铁(①),过滤(操作a),得到A溶液为FeSO4,固体B为Cu和多余的铁,再向B中加过量稀硫酸(②),过滤(操作b)得到的D为Cu,C中含FeSO4、硫酸,最后蒸发、浓缩、冷却、结晶(操作c)得到晶体,以此来解答.
解答:
解:从废水中回收FeSO4和金属铜,由流程可知,先加过量铁(①),过滤(操作a),得到A溶液为FeSO4,固体B为Cu和多余的铁,再向B中加过量稀硫酸(②),过滤(操作b)得到的D为Cu,C中含FeSO4、硫酸,最后蒸发、浓缩、冷却、结晶(操作c)得到晶体,
(1)a为过滤,需要的仪器为漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(2)由上述分析可知,加入的试剂①为Fe;判断所加试剂①是否过量,其操作方法是取少量固体B,加入适量稀硫酸溶解,然后取适量上层清液于试管中,滴加少量双氧水,再滴加2-3滴KSCN溶液,溶液变红,说明铁过量,故答案为:取少量固体B,加入适量稀硫酸溶解,然后取适量上层清液于试管中,滴加少量双氧水,再滴加2-3滴KSCN溶液,溶液变红,说明铁过量;
(3)加入试剂②发生反应的离子方程式是Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)操作c为蒸发、浓缩、冷却、结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩;过滤.
(1)a为过滤,需要的仪器为漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(2)由上述分析可知,加入的试剂①为Fe;判断所加试剂①是否过量,其操作方法是取少量固体B,加入适量稀硫酸溶解,然后取适量上层清液于试管中,滴加少量双氧水,再滴加2-3滴KSCN溶液,溶液变红,说明铁过量,故答案为:取少量固体B,加入适量稀硫酸溶解,然后取适量上层清液于试管中,滴加少量双氧水,再滴加2-3滴KSCN溶液,溶液变红,说明铁过量;
(3)加入试剂②发生反应的离子方程式是Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)操作c为蒸发、浓缩、冷却、结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩;过滤.
点评:本题考查混合物分离提纯的综合应用,为高频考点,把握分离流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意实验的设计意图,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
短周期元素X、Y、Z在元素周期表中的相对位置所示,其中X原子最外层电子数是次外层电子数的3倍.下列说法错误的是( )
| X | |
| Y | Z |
| A、元素X和元素Y的最高正化合价相同 |
| B、气态氢化物的热稳定性:H2Y<H2X |
| C、Y2Z2是共价化合物 |
| D、酸性:HZO4>H2YO4 |
太阳能电池已为人们所熟悉,太阳能电池板的半导体材料是( )
| A、二氧化硅 | B、硅 |
| C、钛合金 | D、铝合金 |
某有机物的分子式为C8H8O2,含有苯环和-COOH的同分异构体有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
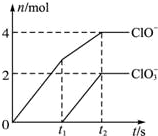 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2═5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2═5CaCl2+Ca(ClO3)2+6H2O.