题目内容
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
(1)在这些元素中,化学性质最不活泼的是: .(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是: .
(3)比较①与⑤的最高价氧化物对应的水化物, 的酸性强(填化学式);能通过 说明(写反应的化学方程式).
(4)实验室制取②的氢化物的化学方程式 ;②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为 ;
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因 (用化学方程式表示)
(6)比较③与⑥的氢化物, 更稳定(填化学式)
(7)写出④的单质与水反应的离子方程式 .
(8)写出⑦元素的离子结构示意图 ,该离子半径 S2-(填“>”或“<”),写出⑩元素在周期表的位置 .
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(3)比较①与⑤的最高价氧化物对应的水化物,
(4)实验室制取②的氢化物的化学方程式
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因
(6)比较③与⑥的氢化物,
(7)写出④的单质与水反应的离子方程式
(8)写出⑦元素的离子结构示意图
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br,
(1)稀有气体化学性质最不活泼;
(2)上述元素中Cl的最高价含氧酸高氯酸酸性最强,K的金属性最强,故KOH碱性最强;
(3)同主族自上而下,非金属性减弱,最高价氧化物对应水化物的酸性减弱;可以利用强酸制备弱酸原理进行验证;
(4)实验室用氯化铵与氢氧化钙反应制备氨气,反应生成氯化钙、氨气与水;氨气与硝酸反应生成硝酸铵;
(5)该红棕色气体为二氧化氮,二氧化氮与水反应生成硝酸与NO,故二氧化氮不能用排水法收集;
(6)同主族自上而下非金属性减弱,气态氢化物稳定性减弱;
(7)钠与水反应生成氢氧化钠与氢气;
(8)氯离子核外有18个电子层,有3个电子层,各层电子数为2、8、8;电子层结构相同,核电荷数越大离子半径越小;溴处于第四周期ⅦA族.
(1)稀有气体化学性质最不活泼;
(2)上述元素中Cl的最高价含氧酸高氯酸酸性最强,K的金属性最强,故KOH碱性最强;
(3)同主族自上而下,非金属性减弱,最高价氧化物对应水化物的酸性减弱;可以利用强酸制备弱酸原理进行验证;
(4)实验室用氯化铵与氢氧化钙反应制备氨气,反应生成氯化钙、氨气与水;氨气与硝酸反应生成硝酸铵;
(5)该红棕色气体为二氧化氮,二氧化氮与水反应生成硝酸与NO,故二氧化氮不能用排水法收集;
(6)同主族自上而下非金属性减弱,气态氢化物稳定性减弱;
(7)钠与水反应生成氢氧化钠与氢气;
(8)氯离子核外有18个电子层,有3个电子层,各层电子数为2、8、8;电子层结构相同,核电荷数越大离子半径越小;溴处于第四周期ⅦA族.
解答:
解:由元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br,
(1)稀有气体Ar最外层为稳定结构,化学性质最不活泼,故答案为:Ar;
(2)上述元素中Cl的最高价含氧酸高氯酸酸性最强,高氯酸化学式为HClO4,K的金属性最强,故KOH碱性最强,故答案为:HClO4;KOH;
(3)同主族自上而下,非金属性减弱,最高价氧化物对应水化物的酸性减弱,故酸性H2CO3>H2SiO3;可以利用强酸制备弱酸原理进行验证,方程式为:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
故答案为:H2CO3;Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
(4)实验室用氯化铵与氢氧化钙反应制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;氨气与硝酸反应生成硝酸铵,化学式为NH4NO3,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;NH4NO3;
(5)该红棕色气体为二氧化氮,二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=2HNO3+NO,故二氧化氮不能用排水法收集,故答案为:3NO2+H2O=2HNO3+NO;
(6)同主族自上而下非金属性减弱,气态氢化物稳定性减弱,故H2O更稳定,故答案为:H2O;
(7)钠与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(8)氯离子核外有18个电子层,有3个电子层,各层电子数为2、8、8,离子结构示意图为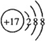 ;电子层结构相同,核电荷数越大离子半径越小,故离子半径Cl-<S2-;溴处于第四周期ⅦA族,
;电子层结构相同,核电荷数越大离子半径越小,故离子半径Cl-<S2-;溴处于第四周期ⅦA族,
故答案为: ;<;第四周期ⅦA族.
;<;第四周期ⅦA族.
(1)稀有气体Ar最外层为稳定结构,化学性质最不活泼,故答案为:Ar;
(2)上述元素中Cl的最高价含氧酸高氯酸酸性最强,高氯酸化学式为HClO4,K的金属性最强,故KOH碱性最强,故答案为:HClO4;KOH;
(3)同主族自上而下,非金属性减弱,最高价氧化物对应水化物的酸性减弱,故酸性H2CO3>H2SiO3;可以利用强酸制备弱酸原理进行验证,方程式为:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
故答案为:H2CO3;Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
(4)实验室用氯化铵与氢氧化钙反应制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(5)该红棕色气体为二氧化氮,二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=2HNO3+NO,故二氧化氮不能用排水法收集,故答案为:3NO2+H2O=2HNO3+NO;
(6)同主族自上而下非金属性减弱,气态氢化物稳定性减弱,故H2O更稳定,故答案为:H2O;
(7)钠与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(8)氯离子核外有18个电子层,有3个电子层,各层电子数为2、8、8,离子结构示意图为
 ;电子层结构相同,核电荷数越大离子半径越小,故离子半径Cl-<S2-;溴处于第四周期ⅦA族,
;电子层结构相同,核电荷数越大离子半径越小,故离子半径Cl-<S2-;溴处于第四周期ⅦA族,故答案为:
 ;<;第四周期ⅦA族.
;<;第四周期ⅦA族.
点评:本题考查元素周期表与元素周期律综合应用,侧重对基础知识的巩固,注意熟练掌握周期表的结构,难度不大.

练习册系列答案
相关题目
按图1的装置进行试验,若图2中X轴表示阴极的电子的量,则Y轴可能表示为( )


| A、Cu2+物质的量浓度 |
| B、C棒的质量 |
| C、Fe棒的质量 |
| D、Cl-物质的量浓度 |
下列说法中,正确的是( )
| A、在纸上层析操作时,要让试样点刚好接触展开剂,否则不能很好地分离 |
| B、实验室制备硝基苯时,先将浓硫酸滴入浓硝酸后,冷却,再边振荡边滴加苯 |
| C、从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| D、向盛有少量Na2O2的试管中加入少量水,并立即滴入2滴酚酞,振荡,溶液呈红色 |
钛被称为21世纪金属.研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图示装置制备金属钛.下列叙述正确的是( )


| A、乙装置阴极的电极反应式为TiO2+4e-═Ti+2O2- |
| B、若不考虑能量的损失,制备24.0g金属钛,需要消耗金属铝36.0g |
| C、甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动 |
| D、乙装置中的石墨电极需要定期更换 |