题目内容
4.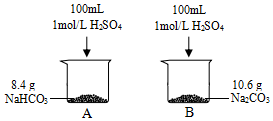 某小组同学在实验室研究Na2CO3与NaHCO3的性质.
某小组同学在实验室研究Na2CO3与NaHCO3的性质.实验Ⅰ:
(1)产生气体的速率A> B(填“>”或“<”或“=”),结合化学用语说明原因Na2CO3与酸反应经历两步:CO32-+H+=HCO3-HCO3-+H+=H2O+CO2↑,而NaHCO3只有一步,因此A中产生气体速率更快.
(2)产生气体的体积A= B(填“>”或“<”或“=”),标准状况下,A烧杯中产生气体的体积为2.24L
(3)任意写出一种将NaHCO3转变为Na2CO3的方法2NaHCO3 $\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).
实验Ⅱ:1mL 0.1mol/L NaHCO3溶液与1mL 0.01mol/L Ca(OH)2溶液混合产生CaCO3白色沉淀.
(4)请用离子方程式表示生成CaCO3的反应过程HCO3-+OH-=CO32-+H2O,Ca2++CO32-=CaCO3↓.
(5)同学们设计了如下实验方案,验证上述反应过程,请将方案补充完整:
| 实验步骤 | 实验现象 |
| ⅰ.取1mL 0.1mol/L NaHCO3溶液,向其中加入 1mL 0.01mol/L CaCl2溶液 | 无明显现象 |
| ⅱ.向上述溶液中滴加NaOH溶液 | 产生白色沉淀 |
分析 (1)同等条件下,碳酸钠与硫酸反应速率不及碳酸氢钠与硫酸反应;
(2)根据碳元素守恒可知产生气体的体积相同;
(3)根据NaHCO3不稳定性,可将NaHCO3加热转变为Na2CO3;
(4)NaHCO3溶液与 Ca(OH)2溶液反应过程为:HCO3-+OH-=CO32-+H2O Ca2++CO32-=CaCO3↓;
(5)NaHCO3溶液中加入CaCl2溶液不反应,滴加NaOH溶液后,产生CaCO3沉淀.
解答 解:(1)发生反应:Na2CO3+H2SO4l═Na2SO4+H2O+CO2↑,2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑,同等条件下,碳酸钠与硫酸反应速率不及碳酸氢钠与硫酸反应,所以A的反应程度更为剧烈,
故答案为:>;Na2CO3与酸反应经历两步:CO32-+H+=HCO3-HCO3-+H+=H2O+CO2↑,而NaHCO3只有一步,因此A中产生气体速率更快;
(2)100mL1mol/LH2SO4溶液为0.1molH2SO4,分别和8,4g(0.1mol)NaHCO3、10.6g(0.1mol)Na2CO3反应,标准状况下,产生的CO2都为2.24L.
故答案为:=;2.24
(3)将NaHCO3加热转变为Na2CO3,2NaHCO3 $\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3 $\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑;
(4)NaHCO3溶液与 Ca(OH)2溶液反应过程为:HCO3-+OH-=CO32-+H2O Ca2++CO32-=CaCO3↓,
故答案为:HCO3-+OH-=CO32-+H2O; Ca2++CO32-=CaCO3↓;
(5)NaHCO3溶液中加入CaCl2溶液不反应,滴加NaOH溶液后,产生CaCO3沉淀.HCO3-+OH-=CO32-+H2O Ca2++CO32-=CaCO3↓,
故答案为:NaOH溶液; 产生白色沉淀.
点评 本题以探究碳酸氢钠、碳酸钠性质为载体考查物质之间反应,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案| A. | 6Li和7Li互为同素异形体 | |
| B. | 锂单质与氧气反应可生成Li2O2和Li2O两种氧化物 | |
| C. | 锂原子在同周期主族元素中原子半径最大 | |
| D. | 少量锂单质保存在煤油中 |
| A. | 盐酸分别与氢氧化钠溶液、澄清石灰水反应 | |
| B. | 硫酸分别与氢氧化钠溶液、氢氧化钡溶液反应 | |
| C. | 硝酸分别与碳酸钠溶液、碳酸钾溶液反应 | |
| D. | 锌分别与稀盐酸、稀硫酸反应 |
| A. | 容量瓶 | B. | 烧杯 | C. | 玻璃棒 | D. | 酒精灯 |
| A. | 铅蓄电池 | B. | 碱性锌锰干电池 | C. | 锂离子可充电池 | D. | 甲醇燃料电池 |
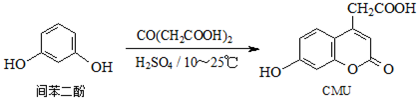
下列说法正确的是( )
| A. | 1molCMU最多可与1molBr2反应 | |
| B. | 1molCMU最多可与3molNaOH反应 | |
| C. | 可用FeCl3溶液鉴别间苯二酚和CMU | |
| D. | CMU在酸性条件下的水解产物只有1种 |
| A. | 18.4 mol•L-1 | B. | 34.7% | C. | 20.4 mol•L-1 | D. | 31.2% |
| A. | pH=1的溶液:NH4+、Fe3+、CO32-、SO42- | |
| B. | 含有大量AlO2-的溶液中:Fe2+、Cu2+、Cl-、Na+ | |
| C. | 中性溶液中:Fe3+、Al3+、Na+、K+、NO3- | |
| D. | Na2S溶液中:K+、NH4+、Cl-、SO42- |

 .
.