题目内容
11.下列关于锂元素的描述正确的是( )| A. | 6Li和7Li互为同素异形体 | |
| B. | 锂单质与氧气反应可生成Li2O2和Li2O两种氧化物 | |
| C. | 锂原子在同周期主族元素中原子半径最大 | |
| D. | 少量锂单质保存在煤油中 |
分析 A、6Li和7Li质子数相同而中子数不同;
B、Li与O2反应只能生成Li2O;
C、电子层相同核电荷数越小半径越大;
D、锂的密度比煤油小.
解答 解:A.6Li和7Li质子数相同而中子数不同,互为同位数,故A错误;
B.Li与O2反应只能生成Li2O,故B错误;
C.电子层相同核电荷数越小半径越大,所以锂原子在同周期主族元素中原子半径最大,故C正确;
D.锂的密度比煤油小,一般保存在石蜡中,故D错误.
故选C.
点评 本题考查碱金属的性质,题目难度不大,明确物质的性质和保存方法是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 在NaHCO3溶液中c(Na+)>c(HCO3-)+2c(H2CO3) | |
| B. | 25℃时,pH=4.75、浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 室温下,向0.1mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 10mL0.1mol•L-1 CH3COOH溶液加入一定质量的量的NaOH后,溶液中离子的浓度由大到小的顺序可能是:c(Na+)>c(CH3COO-)+)>c(OH-)>c(H+) |
2.下列有关酯化反应的说法正确的是( )
| A. | 使用过量的乙醇能使乙酸完全转化为乙酸乙脂 | |
| B. | 酯化反应时,生成的酯基个数与水分子个数相同 | |
| C. | 用过滤的方法分离乙酸乙酯和碳酸钠饱和溶液的混合物 | |
| D. | CH3CH(OH)COOH不能相互反应生成聚脂 |
19.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中“●”和“○”分别代表不同元素的原子.关于此反应说法不正确的是( )


| A. | 可能是双氧水分解反应 | |
| B. | 充分反应后,还有 物质,则属于可逆反应 物质,则属于可逆反应 | |
| C. | 反应前后,一定是共价键的断裂与生成 | |
| D. | 该反应可表示为: = = + + |
6. 用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
 用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )| 气体 | a | b | c | d | |
| A | CO2 | 稀硫酸 | 石灰石 | 饱和Na2CO3溶液 | 浓H2SO4 |
| B | Cl2 | 浓盐酸 | KMnO4固体 | 饱和NaCl溶液 | 浓H2SO4 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 碱石灰 |
| D | H2 | 硝酸 | 锌粒 | H2O | P2O5 |
| A. | A | B. | B | C. | C | D. | D |
16.室温下.下列指定溶液中微粒的浓度关系正确的是( )
| A. | 0.1mol•L-1NH4Cl溶液中:c(CI-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) | |
| C. | 0.1mol•L-1Na2CO3溶液与同浓度等体积盐酸混合的溶液中:c(Na+)>c(CI-)>c(CO32-)>c(HCO3-) | |
| D. | 0.2mol•L-1H2C2O4(弱酸)与0.1mol•L-1NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+c(HC2O4-) |
6.仅利用所提供实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、蒸发皿 | 氯化钠溶液的蒸发结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去二氧化硅中的少量碳酸钙 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体硫酸钠配制0.1 mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
4.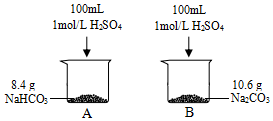 某小组同学在实验室研究Na2CO3与NaHCO3的性质.
某小组同学在实验室研究Na2CO3与NaHCO3的性质.
实验Ⅰ:
(1)产生气体的速率A> B(填“>”或“<”或“=”),结合化学用语说明原因Na2CO3与酸反应经历两步:CO32-+H+=HCO3-HCO3-+H+=H2O+CO2↑,而NaHCO3只有一步,因此A中产生气体速率更快.
(2)产生气体的体积A= B(填“>”或“<”或“=”),标准状况下,A烧杯中产生气体的体积为2.24L
(3)任意写出一种将NaHCO3转变为Na2CO3的方法2NaHCO3 $\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).
实验Ⅱ:1mL 0.1mol/L NaHCO3溶液与1mL 0.01mol/L Ca(OH)2溶液混合产生CaCO3白色沉淀.
(4)请用离子方程式表示生成CaCO3的反应过程HCO3-+OH-=CO32-+H2O,Ca2++CO32-=CaCO3↓.
(5)同学们设计了如下实验方案,验证上述反应过程,请将方案补充完整:
 某小组同学在实验室研究Na2CO3与NaHCO3的性质.
某小组同学在实验室研究Na2CO3与NaHCO3的性质.实验Ⅰ:
(1)产生气体的速率A> B(填“>”或“<”或“=”),结合化学用语说明原因Na2CO3与酸反应经历两步:CO32-+H+=HCO3-HCO3-+H+=H2O+CO2↑,而NaHCO3只有一步,因此A中产生气体速率更快.
(2)产生气体的体积A= B(填“>”或“<”或“=”),标准状况下,A烧杯中产生气体的体积为2.24L
(3)任意写出一种将NaHCO3转变为Na2CO3的方法2NaHCO3 $\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).
实验Ⅱ:1mL 0.1mol/L NaHCO3溶液与1mL 0.01mol/L Ca(OH)2溶液混合产生CaCO3白色沉淀.
(4)请用离子方程式表示生成CaCO3的反应过程HCO3-+OH-=CO32-+H2O,Ca2++CO32-=CaCO3↓.
(5)同学们设计了如下实验方案,验证上述反应过程,请将方案补充完整:
| 实验步骤 | 实验现象 |
| ⅰ.取1mL 0.1mol/L NaHCO3溶液,向其中加入 1mL 0.01mol/L CaCl2溶液 | 无明显现象 |
| ⅱ.向上述溶液中滴加NaOH溶液 | 产生白色沉淀 |
 秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:
秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中: