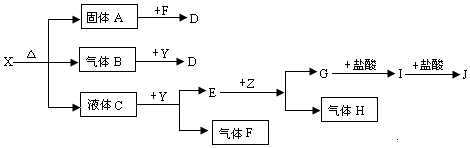
题目内容
4.设标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.901g•cm-3,则氨水中溶质的物质的量浓度是( )| A. | 18.4 mol•L-1 | B. | 34.7% | C. | 20.4 mol•L-1 | D. | 31.2% |
分析 假定1体积为1L,则氨气体积为700L,根据n=$\frac{V}{{V}_{m}}$计算出氨气的物质的量,然后根据m=nM计算出氨气的质量,从而可知氨水的质量,再根据V=$\frac{m}{ρ}$计算出氨水的体积,最后根据c=$\frac{n}{V}$计算出氨水中溶质的物质的量浓度.
解答 解:假定1体积为1L,则氨气体积为700L,
n(NH3)=$\frac{700L}{22.4L/mol}$=31.3 mol,m(NH3)=31.3 mol×17.0 g•mol-1=531 g,
V(氨水)=$\frac{m(N{H}_{3})+m({H}_{2}O)}{{ρ}_{氨水}}=\frac{531g+1000g}{0.901g•c{m}^{-3}}$=1.70×103 mL=1.70 L,
氨水中溶质的物质的量浓度为:c (NH3)=$\frac{31.3mol}{1.70L}$=18.4 mol•L-1,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度不大,正确计算溶液体积为解答关键,注意掌握物质的概念的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
6.仅利用所提供实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、蒸发皿 | 氯化钠溶液的蒸发结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去二氧化硅中的少量碳酸钙 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体硫酸钠配制0.1 mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
7.实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:4CuI+Hg=Cu2HgI4+2Cu.下列有关说法正确的是( )
| A. | 上述反应的产物Cu2HgI4中,Hg的化合价为+2 | |
| B. | 上述反应中CuI既是氧化剂,又是还原剂 | |
| C. | 上述反应中Hg与Cu均发生氧化反应 | |
| D. | 上述反应中生成64gCu时,转移的电子数为6.02×1023 |
4.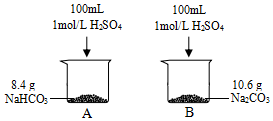 某小组同学在实验室研究Na2CO3与NaHCO3的性质.
某小组同学在实验室研究Na2CO3与NaHCO3的性质.
实验Ⅰ:
(1)产生气体的速率A> B(填“>”或“<”或“=”),结合化学用语说明原因Na2CO3与酸反应经历两步:CO32-+H+=HCO3-HCO3-+H+=H2O+CO2↑,而NaHCO3只有一步,因此A中产生气体速率更快.
(2)产生气体的体积A= B(填“>”或“<”或“=”),标准状况下,A烧杯中产生气体的体积为2.24L
(3)任意写出一种将NaHCO3转变为Na2CO3的方法2NaHCO3 $\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).
实验Ⅱ:1mL 0.1mol/L NaHCO3溶液与1mL 0.01mol/L Ca(OH)2溶液混合产生CaCO3白色沉淀.
(4)请用离子方程式表示生成CaCO3的反应过程HCO3-+OH-=CO32-+H2O,Ca2++CO32-=CaCO3↓.
(5)同学们设计了如下实验方案,验证上述反应过程,请将方案补充完整:
 某小组同学在实验室研究Na2CO3与NaHCO3的性质.
某小组同学在实验室研究Na2CO3与NaHCO3的性质.实验Ⅰ:
(1)产生气体的速率A> B(填“>”或“<”或“=”),结合化学用语说明原因Na2CO3与酸反应经历两步:CO32-+H+=HCO3-HCO3-+H+=H2O+CO2↑,而NaHCO3只有一步,因此A中产生气体速率更快.
(2)产生气体的体积A= B(填“>”或“<”或“=”),标准状况下,A烧杯中产生气体的体积为2.24L
(3)任意写出一种将NaHCO3转变为Na2CO3的方法2NaHCO3 $\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).
实验Ⅱ:1mL 0.1mol/L NaHCO3溶液与1mL 0.01mol/L Ca(OH)2溶液混合产生CaCO3白色沉淀.
(4)请用离子方程式表示生成CaCO3的反应过程HCO3-+OH-=CO32-+H2O,Ca2++CO32-=CaCO3↓.
(5)同学们设计了如下实验方案,验证上述反应过程,请将方案补充完整:
| 实验步骤 | 实验现象 |
| ⅰ.取1mL 0.1mol/L NaHCO3溶液,向其中加入 1mL 0.01mol/L CaCl2溶液 | 无明显现象 |
| ⅱ.向上述溶液中滴加NaOH溶液 | 产生白色沉淀 |
11.下列说法正确的是( )
| A. | 由电子定向移动而导电的物质不一定是金属 | |
| B. | 熔融态的NaHSO4能导电,则中只含有离子键 | |
| C. | HF的沸点高于HCl是因为F的非金属性比Cl强 | |
| D. | 足球烯(C60)和金刚石均为原子晶体,熔化时破坏共价键 |
9.下列说法不正确的是( )
| A. | 氯气可用于漂白纸浆 | |
| B. | 热的纯碱溶液可以去除物品表面的油污 | |
| C. | 钠钾合金常温下是液体,可用于快中子反应堆的热交换剂 | |
| D. | 浓硫酸的吸水性,可使蔗糖炭化,实验室常用作干燥剂 |
13.能正确表示下列反应的离子方程式的是( )
| A. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 磨口玻璃试剂瓶不能盛装烧碱溶液:SiO2+2Na++2OH-=Na2SiO3↓+H2O | |
| C. | 草酸溶液使酸性高锰酸钾溶液褪色:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 检验FeCl2 溶液未完全氧化变质:3Fe2++2[Fe(SCN)6]3-═Fe3[Fe(SCN)6]2↓ |