题目内容
一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电.请完成下列与甲醇有关的问题.
(1)工业上有一种生产甲醇的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ?mol-1
在温度和容积相同的A、B两个容器中,按不同方式投人反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
①从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为 (用含C1的表达式表示).
②a= .
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL-定浓度NaCl与CuSO4混合溶液,其装置如图:
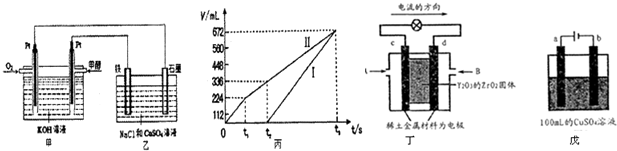
①写出甲中通入甲醇这一极的电极反应式
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t2后,铁电极上的电极反应式 ;在t2时所得溶液的pH为 .(假设溶液体积不变)
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图丁所示装置中,以稀土金属材料做惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y203的Zr02固体,它在高温下能传导02-离子
①d电极的名称为 .
②如图戊所示用铂电极电解足量硫酸铜溶液,b电极上的电极反应式为 .若电解一段时间后要使电解质溶液恢复到电解前的状态,可加入 (填序号).
a. CuO b.Cu(OH)2 c.CuC03 d.Cu2(OH)2C03 .
(1)工业上有一种生产甲醇的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ?mol-1
在温度和容积相同的A、B两个容器中,按不同方式投人反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| CH3OH(g)浓度(mol?L-1) | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |
②a=
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL-定浓度NaCl与CuSO4混合溶液,其装置如图:

①写出甲中通入甲醇这一极的电极反应式
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t2后,铁电极上的电极反应式
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图丁所示装置中,以稀土金属材料做惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y203的Zr02固体,它在高温下能传导02-离子
①d电极的名称为
②如图戊所示用铂电极电解足量硫酸铜溶液,b电极上的电极反应式为
a. CuO b.Cu(OH)2 c.CuC03 d.Cu2(OH)2C03 .
考点:原电池和电解池的工作原理,反应速率的定量表示方法
专题:基本概念与基本理论
分析:(1)①根据方程式知,1mol二氧化碳完全反应放出49kJ能量,则反应放出29.4kJ热量,则参加反应的二氧化碳的物质的量=
=0.6mol,根据方程式知,生成c1mol甲醇需要二氧化碳的物质的量为c1mol/L,从反应开始到达到平衡时,A中用CO2来表示的平均反应速率=
;
②A、B是等效平衡,则A中放出的热量与B中吸收的热量之和为49.0kJ;
(2)①甲是原电池,通入甲醇的电极是负极、通入氧气的电极是正极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
②电解该混合溶液时,阳极上先是氯离子放电生成氯气、后是氢氧根离子放电生成氧气,阴极上先是铜离子放电生成Cu单质,所以没有气体生成,然后是氢离子放电生成氢气,根据图象知,I为阴极发生的反应、II为阳极发生的反应;
在t2后,铁电极上氢离子放电生成氢气、石墨电极上氢氧根离子放电生成氧气,实际上是电解水;
(3)①根据电流方向知,c是正极、d是负极;
②如图戊所示用铂电极电解足量硫酸铜溶液,b电极上铜离子放电生成Cu;若电解一段时间后要使电解质溶液恢复到电解前的状态,根据析出什么加入什么原则加入物质即可.
| 29.4kJ |
| 49.0kJ/mol |
| △c |
| △t |
②A、B是等效平衡,则A中放出的热量与B中吸收的热量之和为49.0kJ;
(2)①甲是原电池,通入甲醇的电极是负极、通入氧气的电极是正极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
②电解该混合溶液时,阳极上先是氯离子放电生成氯气、后是氢氧根离子放电生成氧气,阴极上先是铜离子放电生成Cu单质,所以没有气体生成,然后是氢离子放电生成氢气,根据图象知,I为阴极发生的反应、II为阳极发生的反应;
在t2后,铁电极上氢离子放电生成氢气、石墨电极上氢氧根离子放电生成氧气,实际上是电解水;
(3)①根据电流方向知,c是正极、d是负极;
②如图戊所示用铂电极电解足量硫酸铜溶液,b电极上铜离子放电生成Cu;若电解一段时间后要使电解质溶液恢复到电解前的状态,根据析出什么加入什么原则加入物质即可.
解答:
解:(1)①根据方程式知,1mol二氧化碳完全反应放出49kJ能量,则反应放出29.4kJ热量,则参加反应的二氧化碳的物质的量=
=0.6mol,根据方程式知,生成c1mol甲醇需要二氧化碳的物质的量为c1mol/L,从反应开始到达到平衡时,A中用CO2来表示的平均反应速率=
=
=0.1c1 mol/(L?S),
故答案为:0.1c1 mol/(L?S);
②A、B是等效平衡,则A中放出的热量与B中吸收的热量之和为49.0kJ,则a=49.0kJ-29.4kJ=19.6kJ,
故答案为:19.6;
(2)①甲是原电池,通入甲醇的电极是负极、通入氧气的电极是正极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②电解该混合溶液时,阳极上先是氯离子放电生成氯气、后是氢氧根离子放电生成氧气,阴极上先是铜离子放电生成Cu单质,所以没有气体生成,然后是氢离子放电生成氢气,根据图象知,I为阴极发生的反应、II为阳极发生的反应,阳极电极反应式为2H++2e-=H2↑;
在t2后,铁电极上氢离子放电生成氢气、石墨电极上氢氧根离子放电生成氧气,实际上是电解水,所以溶液pH变化的为t1-t2时间段,阳极上生成氧气体积为(336-224)mL=112mL=0.112L,阳极电极反应式为
2H2O-4e-=4H++O2↑,根据2H2O-4e-=4H++O2↑知,c(H+)=
=0.1mol/L,则溶液的pH=1,
故答案为:2H++2e-=H2↑;1;
(3)①根据电流方向知,c是正极、d是负极,故答案为:负极;
②如图戊所示用铂电极电解足量硫酸铜溶液,b电极上铜离子放电生成Cu,电极反应式为Cu2++2e-═Cu;若电解一段时间后要使电解质溶液恢复到电解前的状态,根据析出什么加入什么原则加入物质即可,用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu,所以相当于析出的物质是CuO,加入CuC03,硫酸和CuC03反应生成硫酸铜和二氧化碳,二氧化碳逸出,相当于加入CuO,所以加入CuO或CuC03都可以使溶液恢复原状,故答案为:Cu2++2e-═Cu;ac.
| 29.4kJ |
| 49.0kJ/mol |
| △c |
| △t |
| c1mol/L |
| 10s |
故答案为:0.1c1 mol/(L?S);
②A、B是等效平衡,则A中放出的热量与B中吸收的热量之和为49.0kJ,则a=49.0kJ-29.4kJ=19.6kJ,
故答案为:19.6;
(2)①甲是原电池,通入甲醇的电极是负极、通入氧气的电极是正极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②电解该混合溶液时,阳极上先是氯离子放电生成氯气、后是氢氧根离子放电生成氧气,阴极上先是铜离子放电生成Cu单质,所以没有气体生成,然后是氢离子放电生成氢气,根据图象知,I为阴极发生的反应、II为阳极发生的反应,阳极电极反应式为2H++2e-=H2↑;
在t2后,铁电极上氢离子放电生成氢气、石墨电极上氢氧根离子放电生成氧气,实际上是电解水,所以溶液pH变化的为t1-t2时间段,阳极上生成氧气体积为(336-224)mL=112mL=0.112L,阳极电极反应式为
2H2O-4e-=4H++O2↑,根据2H2O-4e-=4H++O2↑知,c(H+)=
| ||
| 0.2L |
故答案为:2H++2e-=H2↑;1;
(3)①根据电流方向知,c是正极、d是负极,故答案为:负极;
②如图戊所示用铂电极电解足量硫酸铜溶液,b电极上铜离子放电生成Cu,电极反应式为Cu2++2e-═Cu;若电解一段时间后要使电解质溶液恢复到电解前的状态,根据析出什么加入什么原则加入物质即可,用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu,所以相当于析出的物质是CuO,加入CuC03,硫酸和CuC03反应生成硫酸铜和二氧化碳,二氧化碳逸出,相当于加入CuO,所以加入CuO或CuC03都可以使溶液恢复原状,故答案为:Cu2++2e-═Cu;ac.
点评:本题考查较综合,涉及等效平衡、电解原理、原电池原理等知识点,侧重考查基本理论,明确电解过程中各个电极上发生的反应是解本题关键,注意(3)②中加入CuC03也能使溶液恢复原状,为易错点.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
在《化学1》P.44的【拓展视野】中介绍了二氧化氯是一种新型灭菌消毒剂.以下反应可制得ClO2:2NaClO3+Na2SO3+H2SO4?2ClO2+2Na2SO4+H2O.对于该反应,下列说法中正确的是( )
| A、该反应是复分解反应 |
| B、Na2SO3发生氧化反应 |
| C、H2SO4是氧化剂 |
| D、NaClO3是还原剂 |
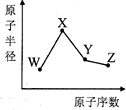 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法正确的是( )| A、对应简单离子半径:X>W |
| B、对应气态氢化物的稳定性Y>Z |
| C、化合物XZW既含离子键,又含共价键 |
| D、Y的氧化物与Z的氧化物和X的最高价氧化物对应的水化物均能反应 |
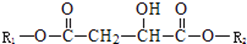 (其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化:
(其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化: