题目内容
前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:2.
(1)X的元素符号为 ,Z元素在元素周期表中的位置为 .
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B稳定性较强的是 (写分子式).
(3)Y、Z的最高价氧化物的水化物酸性较强的是 (写分子式).
(4)12.4g单质Y4所含有的σ键数目为 .
(5)含W元素的最高化合价的含氧酸根离子是 ,该含氧酸根离子在分析化学中有重要作用,在酸性条件下该含氧酸根离子可将Fe2+氧化成Fe3+,请写出该反应的离子方程式: .若要检验是否有Fe3+生成,写出实验操作,现象及结论: .
(1)X的元素符号为
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B稳定性较强的是
(3)Y、Z的最高价氧化物的水化物酸性较强的是
(4)12.4g单质Y4所含有的σ键数目为
(5)含W元素的最高化合价的含氧酸根离子是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:前四周期元素X、Y、Z、W核电荷数依次增加,Y 原子的M层p轨道有3个未成对电子,则外围电子排布为3s23p3,故Y为P元素;Z与Y同周期,且在该周期中电负性最大,则Z为Cl元素;W原子的L层电子数与最外层电子数之比为4:1,最外层电子数为2,其d轨道中的电子数与最外层电子数之比为5:2,d轨道数目为5,外围电子排布为3d54s2,故W为Mn元素,则X、Y、Z、W四种元素的核电荷数之和为58,则X核电荷数为58-15-17-25=1,故X为H元素,据此解答.
解答:
解:前四周期元素X、Y、Z、W核电荷数依次增加,Y 原子的M层p轨道有3个未成对电子,则外围电子排布为3s23p3,故Y为P元素;Z与Y同周期,且在该周期中电负性最大,则Z为Cl元素;W原子的L层电子数与最外层电子数之比为4:1,最外层电子数为2,其d轨道中的电子数与最外层电子数之比为5:2,d轨道数目为5,外围电子排布为3d54s2,故W为Mn元素,则X、Y、Z、W四种元素的核电荷数之和为58,则X核电荷数为58-15-17-25=1,故X为H元素,
(1)由上述分析可知,X的元素符号为:H,Z为Cl元素,在元素周期表中的位置:第三周期第ⅦA族,
故答案为:H;第三周期第ⅦA族;
(2)Y与X形成共价化合物A为PH3,Z与X形成共价化合物B为HCl,由于非金属性P<Cl,故氢化物稳定性较强的是:HCl,
故答案为:HCl;
(3)由于由于非金属性P<Cl,所以磷酸的酸性小于高氯酸,
故答案为:HClO4;
(4)在P4分子中,每个分子中有6个P-P键,12.4gP4的物质的量为0.1mol,含有的σ键数目为0.6NA或3.612×1023 个,
故答案为:0.6NA或3.612×1023 个;
(5)含W(Mn)元素的最高化合价的含氧酸根离子是MnO4-,MnO4-离子与FeSO4溶液反应的离子方程式:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,若要检验是否有Fe3+生成,可以用KSCN溶液,具体实验操作,现象及结论为取少许反应后的溶液于试管中,向试管中加入1~2滴KSCN溶液,若溶液变红,则说明反应有Fe3+生成;反之则无Fe3+生成,
故答案为:MnO4-;MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;取少许反应后的溶液于试管中,向试管中加入1~2滴KSCN溶液,若溶液变红,则说明反应有Fe3+生成;反之则无Fe3+生成.
(1)由上述分析可知,X的元素符号为:H,Z为Cl元素,在元素周期表中的位置:第三周期第ⅦA族,
故答案为:H;第三周期第ⅦA族;
(2)Y与X形成共价化合物A为PH3,Z与X形成共价化合物B为HCl,由于非金属性P<Cl,故氢化物稳定性较强的是:HCl,
故答案为:HCl;
(3)由于由于非金属性P<Cl,所以磷酸的酸性小于高氯酸,
故答案为:HClO4;
(4)在P4分子中,每个分子中有6个P-P键,12.4gP4的物质的量为0.1mol,含有的σ键数目为0.6NA或3.612×1023 个,
故答案为:0.6NA或3.612×1023 个;
(5)含W(Mn)元素的最高化合价的含氧酸根离子是MnO4-,MnO4-离子与FeSO4溶液反应的离子方程式:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,若要检验是否有Fe3+生成,可以用KSCN溶液,具体实验操作,现象及结论为取少许反应后的溶液于试管中,向试管中加入1~2滴KSCN溶液,若溶液变红,则说明反应有Fe3+生成;反之则无Fe3+生成,
故答案为:MnO4-;MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;取少许反应后的溶液于试管中,向试管中加入1~2滴KSCN溶液,若溶液变红,则说明反应有Fe3+生成;反之则无Fe3+生成.
点评:本题主要考查了元素周期表、元素周期律、分子结构、氧化还原反应、离子的检验等知识,中等难度,解题的关键是元素推断,答题时注意审题,第(4)问,P4的结构为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列属于吸热反应同时又属于氧化还原反应的是( )
| A、Ca(OH)2与NH4Cl的反应 |
| B、点燃的镁条在二氧化碳中继续燃烧 |
| C、灼热的碳与二氧化碳的反应 |
| D、酸碱中和反应 |
标准状况下,两种气体的体积相等,则( )
| A、所含原子数一定相等 |
| B、物质的量一定相等 |
| C、质量一定相等 |
| D、密度一定相等 |
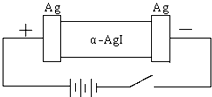 某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.已知铅蓄电池总反应:Pb+PbO2+2H2SO4
某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.已知铅蓄电池总反应:Pb+PbO2+2H2SO4