题目内容
在《化学1》P.44的【拓展视野】中介绍了二氧化氯是一种新型灭菌消毒剂.以下反应可制得ClO2:2NaClO3+Na2SO3+H2SO4?2ClO2+2Na2SO4+H2O.对于该反应,下列说法中正确的是( )
| A、该反应是复分解反应 |
| B、Na2SO3发生氧化反应 |
| C、H2SO4是氧化剂 |
| D、NaClO3是还原剂 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:2NaClO3+Na2SO3+H2SO4═2ClO2+2Na2SO4+H2O中,Cl元素的化合价由+5价降低为+4,S元素的化合价由+4价升高为+6价,以此来解答.
解答:
解:A.该反应中存在化合价的变化,是氧化还原反应,而复分解反应中一定没有元素的化合价变化,故A错误;
B.该反应中S元素的化合价升高,则Na2SO3发生氧化反应,故B正确;
C.Cl元素的化合价降低,在反应中NaClO3得到电子,为氧化剂,H2SO4既不是氧化剂又不是还原剂,故C错误;
D.Cl元素的化合价降低,在反应中NaClO3得到电子,为氧化剂,故D错误;
故选B.
B.该反应中S元素的化合价升高,则Na2SO3发生氧化反应,故B正确;
C.Cl元素的化合价降低,在反应中NaClO3得到电子,为氧化剂,H2SO4既不是氧化剂又不是还原剂,故C错误;
D.Cl元素的化合价降低,在反应中NaClO3得到电子,为氧化剂,故D错误;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握反应中中元素的化合价变化为解答的关键,注意元素化合价的判断,题目难度不大.

练习册系列答案
相关题目
配制一定物质的量浓度的溶液时,会导致所配溶液浓度偏大的操作是( )
| A、在用蒸馏水洗涤烧杯时,洗涤液未全部注入容量瓶中 |
| B、定容摇匀后,发现液面低于刻度线,又加水到刻度线 |
| C、定容时俯视刻度线 |
| D、用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 |
下列关于电解质的说法正确的是( )
| A、SO2溶于水可以导电,说明SO2是电解质 |
| B、电解质本身可以导电,也可以不导电 |
| C、强电解质与弱电解质的差别就是溶液导电性不同 |
| D、物质的量浓度相同的NaOH溶液与氨水,氨水的pH值较小,说明氨水是弱电解质 |
如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
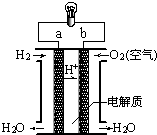

| A、a极是负极 |
| B、正极的电极反应是:O2+2H2O+4e-═4OH- |
| C、电子由a通过灯泡流向b |
| D、氢氧燃料电池是环保电池 |
下列属于吸热反应同时又属于氧化还原反应的是( )
| A、Ca(OH)2与NH4Cl的反应 |
| B、点燃的镁条在二氧化碳中继续燃烧 |
| C、灼热的碳与二氧化碳的反应 |
| D、酸碱中和反应 |
下列各组中的两种物质作用时,反应条件或反应物用量改变时,对生成物没有影响的是( )
| A、Na2O2与CO2 |
| B、Na与O2 |
| C、NaOH与CO2 |
| D、Fe与HNO3 |
下列两种物质中含有的氧原子数不同的是( )
| A、质量比为2:1的SO2和O2 |
| B、9g水和22gCO2 |
| C、12gNO和9.8gH2SO4 |
| D、物质的量相同的H2SO4和H3PO4 |
下列说法中不正确的是( )
| A、物质的量是可以把物质的质量与微观粒子数联系起来的一个基本物理量 |
| B、摩尔是国际单位制中七个基本物理量之一 |
| C、1mol任何微观粒子的质量以克为单位,数值上等于该粒子的相对原子(分子)质量 |
| D、含有6.02×1023个粒子的任何微观粒子集体计量为1摩尔 |