题目内容
8.设阿伏加德罗常数的值为N0,则下列说法正确的是( )| A. | 标准状况下,22.4L乙烯含有的共用电子对数为2N0 | |
| B. | 常温下,含有1 mo1 NaHSO4的溶液中阳离子数为N0 | |
| C. | 通常状况下,1 mo1 NO和0.5 mo1 O2在密闭容器中混合,生成NO2分子数为N0 | |
| D. | 制取漂白粉时,标准状况下22.4 L Cl2参加反应,转移电子数为N0 |
分析 A、乙烯中含6对共用电子对;
B、NaHSO4在溶液中能完全电离为钠离子、氢离子和硫酸根;
C、在NO2气体中存在平衡:2NO2?N2O4;
D、在制取漂白粉的反应中,氯气发生歧化反应.
解答 解:A、乙烯中含6对共用电子对,故标况下22.4L乙烯即1mol乙烯中含6mol共用电子对即6N0个,故A错误;
B、NaHSO4在溶液中能完全电离为钠离子、氢离子和硫酸根,故含有1 mo1 NaHSO4的溶液中阳离子数为2N0,故B错误;
C、1 mo1 NO和0.5 mo1 O2在密闭容器中混合生成1molNO2,而在NO2气体中存在平衡:2NO2?N2O4,导致分子个数小于N0个,故C错误;
D、在制取漂白粉的反应中,氯气发生歧化反应,故标况下22.4L氯气即1mol氯气反应时转移1mol电子即N0个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
8.某气体由烯烃和炔烃混合而成,经测定其密度为同条件下H2的13.5倍,则下列说法中正确的是( )
| A. | 混合气体中一定没有乙炔 | B. | 混合气体中一定有乙稀 | ||
| C. | 混合气体可能由乙炔和丙烯组成 | D. | 混合气体一定由乙烯和乙炔组成 |
16.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 石油、沼气、天然气、植物油都属于可再生能源 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 水蒸气变为液态水时放出的能量就是该变化的反应热 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
3.下列说法中正确的是( )
| A. | 分子式为C5H10的有机化合物全都能使溴水褪色 | |
| B. | 相同条件下,等质量的碳按a、b 两种途径完全转化,途径a 比途径b 放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2O$→_{燃烧}^{O_{2}}$CO2 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 淀粉和纤维素水解的最终水解产物相同 | |
| D. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 |
20. 在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )
在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )
 在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )
在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )| A. | P3>P2T3>T2 | B. | P2>P4T4>T2 | C. | P1>P3T3>T1 | D. | P1>P4T2>T3 |
17.铅蓄电池反应如下:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,对铅蓄电池工作情况,下列叙述错误的是( )
| A. | 放电时Pb极为负极 | |
| B. | 充电时蓄电池上标有“+”号电极连接电源正极 | |
| C. | 放电时正极反应为PbO2+SO42-+4H++2e═PbSO4+2H2O | |
| D. | 充电时蓄电池上标有“-”号的电极发生氧化反应 |
18.下列说法正确的是( )
| A. | 摩尔是一种物理量 | |
| B. | 溶液中或熔融状态下能导电的物质就是电解质 | |
| C. | 氧化还原反应的本质是元素化合价发生了变化 | |
| D. | 得电子的物质被还原,是氧化剂 |
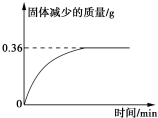 矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.
矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.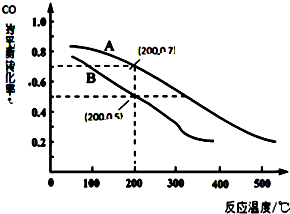 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有: