题目内容
2.下列关于同分异构体异构方式的说法中,正确的是( )| A. | CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构 | |
| B. | 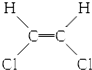 和 和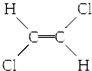 属于位置异构 属于位置异构 | |
| C. | CH2═C(CH3)2和CH3CH═CHCH3属于官能团异构 | |
| D. | CH3CH2CH2COOH和CH3COOCH2CH3属于位置异构 |
分析 A.二者碳的骨架不同,前者没有支链,后者有支链;
B. 和
和 属于顺反异构;
属于顺反异构;
C.CH2═C(CH3)2和CH3CH═CHCH3的官能团相同;
D.CH3CH2CH2COOH和CH3COOCH2CH3的官能团不同.
解答 解:A.CH3CH2CH2CH3和CH3CH(CH3)2碳的骨架不同,前者没有支链,后者有支链,属于碳链异构,故A正确;
B. 和
和 属于顺反异构,不是位置异构,故B错误;
属于顺反异构,不是位置异构,故B错误;
C.CH2═C(CH3)2和CH3CH═CHCH3的官能团相同,不是官能团异构,属于碳链异构、位置异构,故C错误;
D.CH3CH2CH2COOH和CH3COOCH2CH3的官能团不同,属于官能团异构,故D错误;
故选A.
点评 本题考查了同分异构现象和同分异构体,难度不大,明确同分异构体的分类标准及特点是关键.

练习册系列答案
相关题目
12.用惰性电极电解2L 1.0mol/L CuSO4溶液,在电路中通过0.5mol电子后,调换正负极继续电解,电路中通过了1mol电子,此时溶液中c(H+)为(假设体积不变)( )
| A. | 1.5 mol/L | B. | 0.5mol/L | C. | 0.75 mol/L | D. | 0.25 mol/L |
10.实验室中需用3mol/L 的K2CO3溶液480mL,配置时应选用的容量瓶的规格和称取K2CO3的质量分别为( )
| A. | 1000 mL,514.00 g | B. | 480 mL,198.72 g | ||
| C. | 500 mL,207.00 g | D. | 任意规格,207.00 g |
17.铅蓄电池反应如下:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,对铅蓄电池工作情况,下列叙述错误的是( )
| A. | 放电时Pb极为负极 | |
| B. | 充电时蓄电池上标有“+”号电极连接电源正极 | |
| C. | 放电时正极反应为PbO2+SO42-+4H++2e═PbSO4+2H2O | |
| D. | 充电时蓄电池上标有“-”号的电极发生氧化反应 |
7. 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如表:
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为0.05mol/(L•min)
②该条件下反应的平衡常数k=0.15(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向正向(填“正向”、“逆向”或“不移动”),该反应的平衡常数k不变(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是B(选填序号)
A.N2的转化率等于NH3的产率 B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变 D.混合气体的密度不变
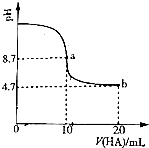
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是CE.
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)=c(A-)+c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L.
 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如表:
| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①0 min~1 min内N2的平均反应速率为0.05mol/(L•min)
②该条件下反应的平衡常数k=0.15(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向正向(填“正向”、“逆向”或“不移动”),该反应的平衡常数k不变(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是B(选填序号)
A.N2的转化率等于NH3的产率 B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变 D.混合气体的密度不变
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是CE.
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)=c(A-)+c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L.
14.某化工厂采用稀NaOH溶液脱除CO2.若碱洗脱除后所得废液的pH约为13(已知:相同温度下饱和Na2CO3溶液的pH约为12),则下列说法正确的是( )
| A. | 该溶液中:c(OH-)>c(Na+)>c(CO32-)>c(HCO3-)>c(H+) | |
| B. | 该溶液中:c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-) | |
| C. | 加水稀释该溶液,恢复至原温度,pH增大,Kw不变 | |
| D. | 该溶液pH约为13的原因:CO32-+H2O═HCO3-+OH- |
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA | |
| B. | 9.2g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA | |
| C. | 完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA | |
| D. | 1L 0.1 mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA |
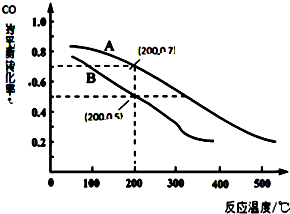 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有: