题目内容
7.盐酸、醋酸和氨水是中学化学中常见的三种物质.某校实验小组利用浓盐酸、冰醋酸和浓氨水分别配制了浓度均为0.1mol•L-1的三种溶液各100mL并进行相关实验据此回答下列问题:
(1)配制上述三种溶液的过程中会用到的玻璃仪器有量筒、烧杯、玻璃棒,以及胶头滴管、100mL容量瓶.
(2)25℃时,利用pH试纸测得0.1mol•L-l醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为10-5;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值将减小(填“增大”、“减小”或“无法确定”)
(3)将浓度均为0.1mo1•L-1的盐酸和氨水等体积混合,所得混合溶液中所有离子的物质的量浓度由大到小的顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);25℃时,用pH计测得此混合溶液的pH为a,则混合溶液中c(NH4+)=0.05+10a-14-10-amo1•L-1(用含a的代数式表示,混合过程中溶液体积的微小变化忽略不计).
分析 (1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)弱电解质存在电离平衡,CH3COOH?CH3COO-+H+,常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH])}$,醋酸溶液的pH约为3,氢离子和醋酸根离子浓度为10-3mol/L,溶液中醋酸溶质浓度近似为0.1mol/L,代入计算得到平衡常数,向10mL此溶液中加入少量冰醋酸,溶解后醋酸溶液浓度增大,醋酸电离程度减小;
(3)①将浓度均为0.1mol•L-1的盐酸和氨水等体积混合恰好反应生成氯化铵溶液,氯化铵溶液水解显酸性;
②依据溶液中电荷守恒计算.
解答 解:(1)由于实验室无450mL容量瓶,故应选择500mL的容量瓶,根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器为烧杯、玻璃棒、托盘天平、100mL容量瓶和胶头滴管,
故答案为:胶头滴管、100mL容量瓶;
(2)25℃时,利用pH试纸测得0.1mol•L-1醋酸溶液的pH约为3,弱电解质存在电离平衡,CH3COOH?CH3COO-+H+,常数Ka=C$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH])}$,醋酸溶液的pH约为3,氢离子和醋酸根离子浓度为10-3mol/L,溶液中醋酸溶质浓度近似为0.1mol/L,则可以估算出醋酸的电离常数约为$\frac{1{0}^{-3}mol/L×1{0}^{-3}mol/L}{0.1mol/L}$=10-5mol/L,
向10mL此溶液中加入少量冰醋酸,溶解后醋酸溶液浓度增大,醋酸电离程度减小,$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值减小,
故答案为:10-5 mol•L-1;减小;
(3)①将浓度均为0.1mol•L-1的盐酸和氨水等体积混合恰好反应生成氯化铵溶液,铵根离子水解溶液显酸性,溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
②25℃时,使用pH计测得此混合溶液的pH为a,溶液中存在电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+),c(NH4+)=c(Cl-)+c(OH-)-c(H+)=0.05+$\frac{1{0}^{-14}}{1{0}^{-a}}$-10-a=0.05+10a-14-10-a ,
故答案为:0.05+10a-14-10-a.
点评 本题考查了溶液配制,弱电解质电离平衡影响因素和电离平衡常数的计算,电解质溶液中离子浓度大小比较、盐类水解的应用,题目难度中等,侧重于考查学生的分析能力和计算能力.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
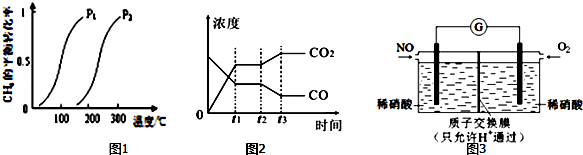
此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-2.
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.
| A. | 混合气体中一定没有乙炔 | B. | 混合气体中一定有乙稀 | ||
| C. | 混合气体可能由乙炔和丙烯组成 | D. | 混合气体一定由乙烯和乙炔组成 |
| A. | 1.5 mol/L | B. | 0.5mol/L | C. | 0.75 mol/L | D. | 0.25 mol/L |
| A. | 石油、沼气、天然气、植物油都属于可再生能源 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 水蒸气变为液态水时放出的能量就是该变化的反应热 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
| A. | 放电时Pb极为负极 | |
| B. | 充电时蓄电池上标有“+”号电极连接电源正极 | |
| C. | 放电时正极反应为PbO2+SO42-+4H++2e═PbSO4+2H2O | |
| D. | 充电时蓄电池上标有“-”号的电极发生氧化反应 |
 矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.
矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.