题目内容
20. (CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.
(CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.回答下列问题:
(1)N、O、S 的第一电离能由大到小的顺序为N>O>S.
(2)写出两种结构与OCN-相似的三原子分子CO2、N2O、CS2等(填分子式).
(3)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态.配离子的中心原子核外电子排布式为[Ar]3d6(或1s22s22p63s23p63d6).
(4)(CN)2 在一定条件下氢化可以得到乙二胺(H2NCH2CH2NH2).
①(CN)2的空间构型为直线形,其中C 原子的轨道杂化方式为sp杂化;1mol (CN)2中含有π 键的数目为2.408×1024(或4NA).
②乙二胺(H2NCH2CH2NH2)和三甲胺[(CH3)3N]中沸点较高的是:乙二胺,判断的依据是:乙二胺分子间形成氢键,三甲胺分子中N原子上无氢,无法形成氢键.
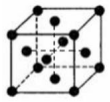
(5)CN-配合物用于黄金冶炼.金的立方晶胞结构如图所示.
晶体中每个Au 原子周围紧邻等距的Au 原子有12个;晶胞中Au 原子的体积占晶胞体积的百分率为74%.(计算结果保留2 位有效数字)
分析 (1)同一周期,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于第VIA族元素,同一主族,元素的第一电离能随着原子序数的增大而减小;
(2)原子个数相等且价电子数相等的分子或离子为等电子体,等电子体结构相似;
(3)配合物中心离子为Fe2+,根据其核外电子数,写出核外电子排布式;
(4)①根据价层电子对互斥理论判断该分子空间构型,其中C 原子价层电子对为2,据此判断轨道杂化方式,共价单键为σ键,共价双键中一个是σ键一个是π键,共价三键中一个是σ键两个是π键;
②氢键影响物质的溶沸点,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键;
(5)Au位于立方体的顶点和面心上,以顶点上的Au为例,与它距离最近的Au分布在与该顶点相连的12个面的面心上,在晶胞结构中,晶胞的面对角线等于Au原子半径的4倍,空间利用率=$\frac{所有Au原子体积}{晶胞体积}$×100%,据此计算晶胞中Au 原子的体积占晶胞体积的百分率.
解答 解:(1)同一周期,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于第VIA族元素,同一主族,元素的第一电离能随着原子序数的增大而减小,所以第一电离能大小顺序是:N>O>S,
故答案为:N>O>S;
(2)等电子体结构相似,OCN-含有3个原子,价电子总数为6+4+5+1=16,故其等电子体为CO2、N2O、CS2等,它们结构与OCN-相似,
故答案为:CO2、N2O、CS2等;
(3)配合物中心离子为Fe2+,核外电子数为24,其价电子排布式为:3d6,内部电子排布式与Ar核外电子排布式完全一样,故其离子排布式为:[Ar]3d6(或1s22s22p63s23p63d6),
故答案为:[Ar]3d6(或1s22s22p63s23p63d6);
(4)①该分子的结构式为N≡C-C≡N,其中C 原子价层电子对为2,C 原子的轨道杂化方式为sp杂化,空间构型为直线形,该分子中含有3个σ键4个π键,1mol (CN)2中含有π 键的数目为2.408×1024(或4NA),
故答案为:直线形;sp杂化;2.408×1024(或4NA);
②分子之间可以形成氢键使物质的溶沸点升高,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子中N原子上无氢,分子之间不能形成氢键,故乙二胺的沸点较高,
故答案为:乙二胺;乙二胺分子间形成氢键.三甲胺分子中N原子上无氢,无法形成氢键;
(5)Au位于立方体的顶点和面心上,以顶点上的Au为例,与它距离最近的Au分布在与该顶点相连的12个面的面心上,Au原子半径为d,对角线上三个Au原子相邻,对角线长度=4d,则晶胞棱长=$\sqrt{\frac{(4d)^{2}}{2}}$=2$\sqrt{2}$d,晶胞体积=(2$\sqrt{2}$d)3,该晶胞中Au原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞密度=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}d)^{3}}$g/cm3=$\frac{\sqrt{2}M}{8{N}_{A}{d}^{3}}$g/cm3;每个Au原子体积=$\frac{4}{3}$πd3,该晶胞中含有4个Au原子,所以晶胞中所有Au原子体积=4×$\frac{4}{3}$πd3,空间利用率=$\frac{所有Au原子体积}{晶胞体积}$×100%=$\frac{4×\frac{4}{3}×π×{d}^{3}}{(2\sqrt{2}d)^{3}}$=74%,
故答案为:12; 74%.
点评 本题考查物质结构和性质有关知识,涉及第一电离能的判断、等电子体的性质,核外电子排布式的书写,侧重于考查晶胞结构的分析和计算,注意同一周期中第一电离能的变化趋势及异常现象,为易错点,注意利用均摊法计算晶胞中各种原子个数,题目难度中等.

| A. | Na2O2 | B. | CaCL2 | C. | 氮气 | D. | CCL4 |
| A. | 氯化铵和草木灰混合使用,能增强化肥的肥效 | |
| B. | 二氧化硫和漂白粉混合使用,能增强漂白效果 | |
| C. | 浓盐酸和高锰酸钾混合使用,能增强高锰酸钾的氧化性 | |
| D. | 氢氧化钠固体和氧化钙混合使用,能增加吸水能力 |
| A. |  二溴乙烷 二溴乙烷 | B. |  3乙基1丁烯 3乙基1丁烯 | ||
| C. |  2甲基2,4己二烯 2甲基2,4己二烯 | D. |  2,4,4三甲基戊烷 2,4,4三甲基戊烷 |
| A. | 把金属铁放入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将氢氧化铁放入盐酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 氢氧化钡跟硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 石灰石跟盐酸反应:CO32-+2H+═H2O+CO2↑ |
| A. | 加入少量NaOH溶液 | B. | 加入少量的NaHSO4溶液 | ||
| C. | 加入少量的CH3COONa溶液 | D. | 加入少量的CuSO4溶液 |
| A. | 盛放食醋 | B. | 烧煮开水 | C. | 盛放咸的食物 | D. | 用碱水洗涤 |
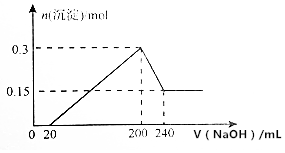 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示(不考虑金属和盐酸反应时HCl的挥发).
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示(不考虑金属和盐酸反应时HCl的挥发).