题目内容
11.生活离不开化学,下列说法正确的是( )| A. | 氯化铵和草木灰混合使用,能增强化肥的肥效 | |
| B. | 二氧化硫和漂白粉混合使用,能增强漂白效果 | |
| C. | 浓盐酸和高锰酸钾混合使用,能增强高锰酸钾的氧化性 | |
| D. | 氢氧化钠固体和氧化钙混合使用,能增加吸水能力 |
分析 A.氨根离子与碳酸根离子发生双水解生成氨气;
B.二氧化硫与次氯酸钙发生氧化还原反应生成硫酸钙;
C.浓盐酸能够被高锰酸钾氧化;
D.氢氧化钠固体和氧化钙都具有吸水性.
解答 解:A.氯化铵和草木灰混合会放出氨气,使肥效降低,所以不能将氯化铵和草木灰混合使用,故A错误;
B.二氧化硫与次氯酸钙发生氧化还原反应生成硫酸钙,硫酸钙不具有漂白性,所以二者混合使用漂白效果减弱,故B错误;
C.浓盐酸能够被高锰酸钾氧化,所以不能用浓盐酸酸化高锰酸钾,故C错误;
D.氢氧化钠固体和氧化钙都具有吸水性,二者混合物为碱石灰,具有强的吸水性,故D正确;
故选:D.
点评 本题考查了元素化合物知识,侧重考查物质的性质与用途,明确盐类水解规律、熟悉二氧化硫、次氯酸钙、高锰酸钾等物质的性质是解题关键,题目难度不大.

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
1.下列说法正确的是( )
| A. | 用分液漏斗分离除去溴苯中混入的溴 | |
| B. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| C. | 1mol葡萄糖可水解生成2mol乳酸(C3H6O3) | |
| D. | 结构简式为 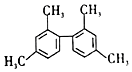 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 |
2.其他条件不变,下列数据随温度升高的变化趋势一定正确的是( )
| A. | 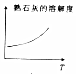 | B. |  | C. | 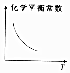 | D. | 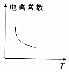 |
6.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”.火药燃烧爆炸时发生的反应为:S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1.
已知:
①碳的燃烧热△H1=a kJ•mol-1
②S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
已知:
①碳的燃烧热△H1=a kJ•mol-1
②S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
| A. | 3a+b-c | B. | c-3a-b | C. | a-b-c | D. | c-a-b |
16.NaOH标准溶液的配制和标定,需经过NaOH溶液配制,基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作.下列有关说法正确的是( )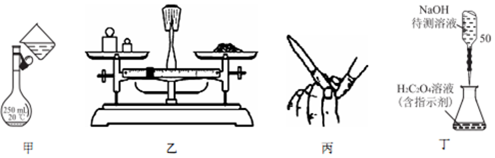

| A. | 用图甲所示操作转移NaOH 溶液到容量瓶中 | |
| B. | 用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体 | |
| C. | 用图丙所示操作检查碱式滴定管是否漏液 | |
| D. | 用图丁所示装置以NaOH 待测液滴定H2C2O4溶液 |
3.下列关于NO2的说法正确的是( )
| A. | NO2 是无色气体 | |
| B. | NO2 能用排水气法收集 | |
| C. | NO2能与水反应,在反应中氮元素的化合价不发生变化 | |
| D. | NO2能与水反应,在反应中NO2既是氧化剂,又是还原剂 |
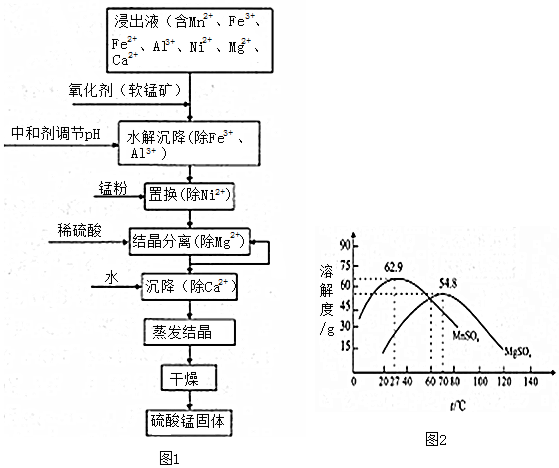
 (CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.
(CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.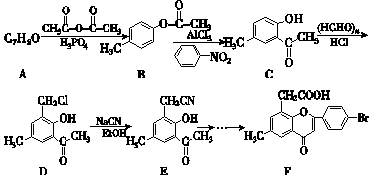
 +2NaOH→
+2NaOH→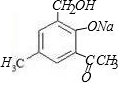 +H2O+NaCl.
+H2O+NaCl.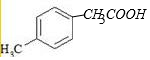 .
.