题目内容
15.下列反应的离子方程式正确的是( )| A. | 把金属铁放入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将氢氧化铁放入盐酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 氢氧化钡跟硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 石灰石跟盐酸反应:CO32-+2H+═H2O+CO2↑ |
分析 A.铁与稀硫酸反应生成的是亚铁离子;
B.氢氧化铁与盐酸反应生成氯化铁和贺岁;
C.漏掉了铜离子与氢氧根离子生成氢氧化铜的反应;
D.石灰石的主要成分为碳酸钙,碳酸钙为难溶物,不能拆开.
解答 解:A.把金属铁放入稀硫酸,反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.将氢氧化铁放入盐酸中,二者反应生成氯化铁和水,反应的离子方程式为Fe(OH)3+3H+═Fe3++3H2O,故B正确;
C.氢氧化钡跟硫酸铜溶液反应生成氢氧化铜和硫酸钡沉淀,正确的离子方程式为:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故C错误;
D.碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
5.在某钠盐溶液中,除Cl-之外可能还含有等物质的量的下列阴离子中的一种或多种:SO32-、CO32-、SiO32-、I-、NO3-、SO42-.在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种.关于此溶液,下列说法正确的是( )
| A. | 原溶液中可能含有SiO32- | |
| B. | 生成的气体中一定有NO,可能含有CO2 | |
| C. | 溶液中减少的离子是SO32-、I-、NO3- | |
| D. | 原溶液中一定含有SO42- |
6.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”.火药燃烧爆炸时发生的反应为:S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1.
已知:
①碳的燃烧热△H1=a kJ•mol-1
②S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
已知:
①碳的燃烧热△H1=a kJ•mol-1
②S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
| A. | 3a+b-c | B. | c-3a-b | C. | a-b-c | D. | c-a-b |
3.下列关于NO2的说法正确的是( )
| A. | NO2 是无色气体 | |
| B. | NO2 能用排水气法收集 | |
| C. | NO2能与水反应,在反应中氮元素的化合价不发生变化 | |
| D. | NO2能与水反应,在反应中NO2既是氧化剂,又是还原剂 |
10.某烃中碳和氢的质量比是24:5,该烃在标准状况下的密度是2.59g/L,其分子式为( )
| A. | C2H6 | B. | C4H10 | C. | C5H12 | D. | C4H8 |
7.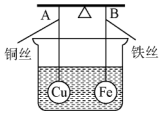 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A端高B端低 | |
| B. | 杠杆为导体和绝缘体时,均为A端低B端高 | |
| C. | 当标杆为绝缘体时,A端低B端高;为导体时,A端高B端低 | |
| D. | 当标杆为绝缘体时,A端高B端低;为导体时,A端低B端高 |
4. 如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )
 如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn | |
| C. | 若两电极都是金属,则它们的活动性为 X>Y | |
| D. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 |
14.25℃时,对下列各溶液的叙述中正确的是( )
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 4种pH相同的溶液:①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH,各溶液的物质的量浓度由大到小的顺序是③>②>①>④ | |
| C. | 0.1 mol•L-1HA(某酸)的pH=3,0.1 mol•L-1 BOH(某碱)的pH=13,则BA(盐)溶液的pH<7 | |
| D. | pH=2的盐酸与pH=l的硫酸溶液中c(H+)之比为2:1 |
 (CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.
(CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.