题目内容
19.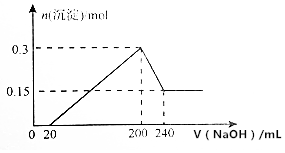 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示(不考虑金属和盐酸反应时HCl的挥发).
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示(不考虑金属和盐酸反应时HCl的挥发).求:
(1)混合物中铝的质量.
(2)NaOH的物质的量浓度.
(3)盐酸的浓度.
分析 由图可知,金属与酸反应后酸剩余,0~20mL发生HCl+NaOH=NaCl+H2O,20mL~200mL时生成Mg(OH)2和Al(OH)3,200mL~240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,图中n[Mg(OH)2]=0.15mol,n[Al(OH)3]=0.3mol-0.15mol=0.15mol,200mL时生成沉淀最多,n(NaCl)=n(HCl)=n(NaOH),以此来解答.
解答 解:(1)n[Al(OH)3]=0.3mol-0.15mol=0.15mol,由Al原子守恒可知,混合物中Al为0.15mol×27g/mol=4.05g,
答:混合物中铝的质量为4.05g;
(2)200mL~240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,设NaOH的浓度为x,则0.15mol=x×0.04L,解得x=3.75mol/L,
答:NaOH的物质的量浓度为3.75mol/L;
(3)200mL时生成沉淀最多,n(NaCl)=n(HCl)=n(NaOH),设HCl的浓度为y,则0.1L×y=0.2L×3.75mol/L,解得y=7.5mol/L,
答:盐酸的浓度为7.5mol/L.
点评 本题考查混合物的计算,为高频考点,把握图中曲线与反应的对应关系、原子守恒为解答的关键,侧重分析与计算能力的考查,注意氢氧化铝的两性,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
7.下列关于离子共存或离子检验的说法正确的是( )
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4-、Al3+ | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32-、CO32- | |
| C. | 含有大量AlO2-的溶液中:K+、HCO3-、Br-、Na+可共存 | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,最终溶液中无沉淀,阴离子种数减少3种,则原溶液中一定有CO32- |
14.25℃时,对下列各溶液的叙述中正确的是( )
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 4种pH相同的溶液:①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH,各溶液的物质的量浓度由大到小的顺序是③>②>①>④ | |
| C. | 0.1 mol•L-1HA(某酸)的pH=3,0.1 mol•L-1 BOH(某碱)的pH=13,则BA(盐)溶液的pH<7 | |
| D. | pH=2的盐酸与pH=l的硫酸溶液中c(H+)之比为2:1 |
4.将Υ1L的H2和Υ2L的N2在一定条件下发生反应,达到平衡后,混合气体总体积为Υ3L(气体体积均在相同条件下测定),则生成NH3的体积是( )
| A. | (Υ1+Υ2-Υ3)L | B. | (Υ1+Υ2+Υ3)L | C. | (Υ1+Υ2-2Υ3)L | D. | [Υ3-(Υ1+Υ2)]L |
11.某温度下,在一个2L的密闭容器中加入4mol A和 2mol B进行如下反应:3A(g)+2B(g)?4C(s)+D(g),反应2min 后达到平衡,测得生成1.6mol C,下列说法正确的是( )
| A. | 前2 min,D的平均反应速率为0.2 mol•L-1•min-1 | |
| B. | 此时,B的平衡转化率是40% | |
| C. | 增大该体系的压强,平衡不移动,化学平衡常数不变 | |
| D. | 增加B,平衡向右移动,B的平衡转化率增大 |
8.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,下列说法正确的是( )
| A. | 2 L二氧化碳分解生成2 L一氧化碳和1 L氧气吸收576 kJ热量 | |
| B. | 恒压条件下生成物的总焓大于反应物的总焓 | |
| C. | 在相同条件下,2 mol一氧化碳与1 mol氧气的能量总和大于2 mol二氧化碳的能量 | |
| D. | 一氧化碳的燃烧热是566 kJ/mol |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 100g 98%的浓硫酸中含有的氢原子数目为2NA | |
| B. | 常温下,2.7gAI与足量浓度为18mo1/L的浓硫酸反应时,转移的电子数为0.3NA | |
| C. | 标准状况下,22.4L的CCI4含有的CCl4分子数大于NA | |
| D. | 1 mol笨完全转化为环己烷,参与反应的碳碳双键数为3NA |
 (CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.
(CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.
 +2NaOH→
+2NaOH→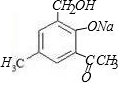 +H2O+NaCl.
+H2O+NaCl. .
.