题目内容
12.工业上,以钛铁矿为原料制备二氧化钛的工艺流程如图1所示.钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分Fe2+在风化过程中会转化为+3价.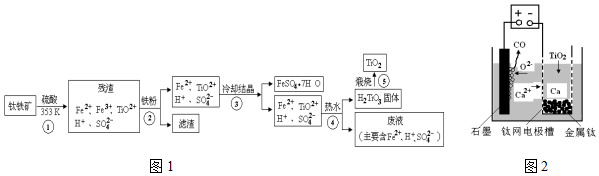
已知:TiO(OH)2(即H2TiO3)为两性氢氧化物
(1)步骤②中,发生反应的主要离子方程式为2Fe3++Fe═3Fe2+.
(2)步骤③中,实现混合物的分离是利用物质的B(填字母序号).
A.熔沸点差异 B.溶解性差异 C.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是过滤(填操作名称).
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,当加入热水将溶液稀释、升温后,平衡正向移动,生成H2TiO3.
(5)上述工艺流程中可以循环利用的物质是H2SO4或硫酸.
(6)研究发现,可以用石墨作阳极、铁网作阴极、熔触CaF2-CaO作电解质,利用图2所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.
①写出阳极所发生反应的电极反应式2O2--4e-=O2↑或C+O2--2e-=CO↑.
②在制备金属Ti前后,CaO的质量将不变(填“增大”、“不变”或“减小”)
分析 (1)由流程可知:铁粉将Fe3+转化为Fe2+;
(2)溶液中析出晶体是利用物质溶解度的不同得到;
(3)②③④都是从溶液中得到固体的分离过程,需要用过滤装置;
(4)依据溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,平衡影响因素和平衡移动原理分析判断;
(5)流程中生成了硫酸,可循环使用;
(6)①依据装置图分析判断,阳极生成一氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的一氧化碳;
②制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca 阳极:2O2--4e-═O2↑,2Ca+TiO2$\frac{\underline{\;一定条件\;}}{\;}$Ti+2CaO,由此可见,CaO的量不变.
解答 解:(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe═3Fe2+;
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到;
故答案为:B;
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液;
故答案为:过滤;
(4)步骤④中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2;溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3;
故答案为:溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,当加入热水将溶液稀释、升温后,平衡正向移动,生成H2TiO3;
(5)流程中生成了硫酸,步骤①中使用硫酸,可循环使用;
故答案为:H2SO4或硫酸;
(6)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成一氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的一氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+O2--4e-=CO↑;
故答案为:2O2--4e-=O2↑或C+O2--2e-=CO↑;
②制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca 阳极:2O2--4e-═O2↑;2Ca+TiO2$\frac{\underline{\;一定条件\;}}{\;}$Ti+2CaO,由此可见,CaO的量不变;
故答案为:不变.
点评 本题考查了物质制备流程分析判断,为高考常见题型,综合考查实验基本操作,离子方程式的书写等,考查学生对所学知识的综合应用能力,注意物质分离的流程分析判断,物质性质的应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | NO2 是无色气体 | |
| B. | NO2 能用排水气法收集 | |
| C. | NO2能与水反应,在反应中氮元素的化合价不发生变化 | |
| D. | NO2能与水反应,在反应中NO2既是氧化剂,又是还原剂 |
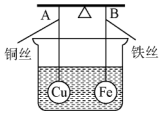 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A端高B端低 | |
| B. | 杠杆为导体和绝缘体时,均为A端低B端高 | |
| C. | 当标杆为绝缘体时,A端低B端高;为导体时,A端高B端低 | |
| D. | 当标杆为绝缘体时,A端高B端低;为导体时,A端低B端高 |
 如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn | |
| C. | 若两电极都是金属,则它们的活动性为 X>Y | |
| D. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 |
| A. | 前2 min,D的平均反应速率为0.2 mol•L-1•min-1 | |
| B. | 此时,B的平衡转化率是40% | |
| C. | 增大该体系的压强,平衡不移动,化学平衡常数不变 | |
| D. | 增加B,平衡向右移动,B的平衡转化率增大 |
 (CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.
(CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.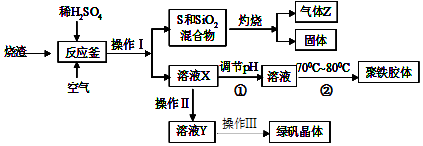
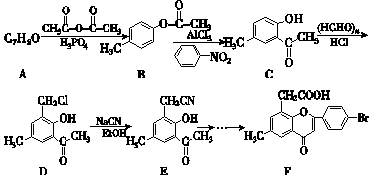
 +2NaOH→
+2NaOH→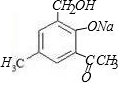 +H2O+NaCl.
+H2O+NaCl.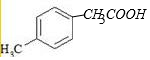 .
.