题目内容
11.下列反应中,不属于可逆反应的是( )| A. | 2NO2=N2O4与N2O4=2NO2 | |
| B. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI与2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2 | |
| C. | CO2+H2O=H2CO3与 H2CO3=CO2↑+H2O | |
| D. | CaO+CO2=CaCO3与CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
分析 可逆反应可正逆两个方向进行,且反应条件相同,以此来解答.
解答 解:A、B、C中均为可逆反应,只有D中反应条件不同,二者不是可逆反应,
故选D.
点评 本题考查可逆反应,为高频考点,把握可逆反应的特征为解答的关键,侧重分析与应用能力的考查,注意反应条件的判断,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
1.某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol•L-1.
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
②取少量溶液,加入KSCN溶液无明显变化.
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由①、②、③判断,溶液中一定不含有的阳离子是K+、Fe3+,一定不含的阴离子是CO32-、SiO32-(写离子符号).
(2)③中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,④中生成白色沉淀的离子方程式是SO42-+Ba2+=BaSO4↓.
(3)将③中所得红棕色气体通入水中,气体变无色,所发生的化学反应方程式为3NO2+H2O=2HNO3+NO.
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Mg2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
| 阳离子 | K+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
②取少量溶液,加入KSCN溶液无明显变化.
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由①、②、③判断,溶液中一定不含有的阳离子是K+、Fe3+,一定不含的阴离子是CO32-、SiO32-(写离子符号).
(2)③中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,④中生成白色沉淀的离子方程式是SO42-+Ba2+=BaSO4↓.
(3)将③中所得红棕色气体通入水中,气体变无色,所发生的化学反应方程式为3NO2+H2O=2HNO3+NO.
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Mg2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
2.化学科学需要借助化学专用语言描述,下列有关化学用语书写正确的是( )
| A. | CO2的电子式 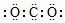 | B. | Cl-的结构示意图 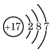 | ||
| C. | HCl的电子式 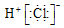 | D. | 质量数为37的氯原子${\;}_{17}^{37}$Cl |
19.下列说法中正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核较近的区域内运动 | |
| B. | 凡单原子形成的稳定离子,一定具有稀有气体元素原子的8电子稳定结构 | |
| C. | Na2O2属于离子化合物,熔化时只破坏离子键,不破坏O-O共价键 | |
| D. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
6.R原子的质量数为Y,mgR2-中含有电子Xmol.则R原子核内中子数为( )
| A. | $\frac{mY-XY+2m}{m}$ | B. | Y-X+2 | C. | $\frac{mY+XY-2m}{m}$ | D. | Y-X-2 |
16.下列水解化学方程式或水解离子方程式正确的是( )
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | CH3COOH+OH-?CH3COO-+H2O | D. | NaCl+H2O?NaOH+HCl |
20. 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )| A. | 该反应的平衡常数表达式为:K=$\frac{{C}_{(C)}}{{{C}^{2}}_{(A)}•{C}_{(B)}}$ | |
| B. | 0~4 min时,A的平均反应速率为0.01 mol/(L•min) | |
| C. | 由T1向T2变化时,v正>v逆 | |
| D. | 平衡后升高温度,K值增大 |
 ;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.
;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl. .
.