题目内容
16.乙苯催化脱氢制苯乙烯反应:
(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的压强平衡常数Kp=$\frac{{a}^{2}}{(1-{a}^{2})}P$(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
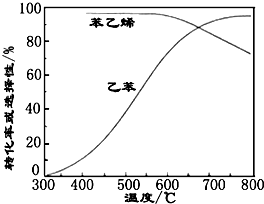
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦
合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO,据此可推知新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
分析 (1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差;
(2)参加反应的乙苯为nα mol,则:
 ?
? +H2
+H2
开始(mol):n 0 0
转化(mol):nα nα nα
平衡(mol):n(1-α) nα nα
维持体系总压强p恒定,计算平衡时各组分分压,再根据Kp=$\frac{P(苯乙酸)×P({H}_{2})}{P(乙苯)}$计算;
(3)①保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
②600℃时乙苯的转化率与苯乙烯的选择性均较高;结合温度对乙苯转化率、苯乙烯选择性、温度对反应速率与催化剂的影响及消耗能量等,分析控制反应温度为600℃的理由;
(4)①CO2与H2反应,导致氢气浓度减低,有利于乙苯脱氢反应的化学平衡右移;
②由题目信息可知,在保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度,消耗的能量减少;
③由于会发生反应CO2+C═2CO,有利于减少积炭;
④CO2代替水蒸气,有利用CO2资源利用.
解答 解:(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ•mol-1=+124kJ•mol-1,
故答案为:+124kJ•mol-1;
(2)物质的量为n的乙苯蒸气发生催化脱氢反应,参加反应的乙苯为nα mol,则:
 ?
? +H2
+H2
开始(mol):n 0 0
转化(mol):nα nα nα
平衡(mol):n(1-α) nα nα
维持体系总压强p恒定,压强平衡常数Kp═$\frac{P(苯乙酸)×P({H}_{2})}{P(乙苯)}$=$\frac{\frac{na}{n(1+a)}p×\frac{na}{n(1+a)}p}{\frac{n(1-a)}{n(1+a)}p}$=$\frac{{a}^{2}}{(1-{a}^{2})}P$,
故答案为:$\frac{{a}^{2}}{(1-{a}^{2})}P$;
(3)①正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率,
故答案为:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动;
②600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大,故选择600℃左右,
故答案为:600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大;
(4)①CO2与H2反应,导致氢气浓度减低,有利于乙苯脱氢反应的化学平衡右移,故正确;
②由题目信息可知,在保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度,消耗的能量减少,故正确;
③由于会发生反应CO2+C═2CO,有利于减少积炭,故正确;
④CO2代替水蒸气,有利用CO2资源利用,故正确,
故答案为:①②③④.
点评 本题考查反应热计算、化学平衡常数计算、反应速率及平衡移动的影响因素、对条件控制的分析评价等,(1)中认为苯环存在单双键交替形式不影响计算结构,题目难度较大.

 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料.(1)实验室可由环己醇制备环己烯,反应的化学方程式是
 .
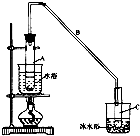
.(2)实验装置如下图所示,将10mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.环己醇和环己烯的部分物理性质如下:
| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
②试管A置于水浴中的目的是受热均匀,便于控温;
试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(3)环己烯粗品中含有少量环己醇和酸性杂质.精制环己烯的方法是:
①向环己烯粗品中加入C(填入编号),充分振荡后,分液(填操作名称).
A.Br2的CCl4溶液 B.稀H2SO4 C.Na2CO3溶液
②再对初步除杂后的环己烯进行蒸馏,得到环己烯精品.蒸馏时,蒸馏烧瓶中要加入少量生石灰,目的是除去产品中少量的水.
③实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(4)以下区分环己烯精品和粗品的方法,合理的是B.
A.加入水观察实验现象
B.加入金属钠观察实验现象
C.加入酸性高锰酸钾溶液,振荡后观察实验现象.
| A. | 1mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | Ba(OH)2溶液 | D. | BaCl2溶液 |
| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K=1.8mol•L-1;
(3)要增大该反应的K值,可采取的措施有(填序号)D
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度.
 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),已知3种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
(4)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.