题目内容
8.取38.4g铜与适量的浓硝酸反应,铜全部反应后,共收集到22.4L(标准状况)气体,反应消耗HNO3的物质的量可能是( )| A. | 1mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
分析 n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,收集到的气体可能是NO、NO2或二者混合物,n(NOx)=$\frac{22.4L}{22.4L/mol}$=1mol,根据N原子守恒计算被还原硝酸的物质的量,根据Cu(NO3)2计算体现酸性的硝酸,反应消耗n(HNO3)=n(HNO3) (酸性)+n(HNO3)(被还原).
解答 解:n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,收集到的气体可能是NO、NO2或二者混合物,n(NOx)=$\frac{22.4L}{22.4L/mol}$=1mol,
根据N、Cu原子守恒得体现酸性n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2×0.6mol=1.2mol,
根据N元素守恒得被还原n(HNO3)(被还原)=n(NOx)=1mol,
反应消耗n(HNO3)=n(HNO3) (酸性)+n(HNO3)(被还原)=1.2mol+1mol=2.2mol,故选C.
点评 本题考查氧化还原反应计算,为高频考点,明确各个物理量的关系是解本题关键,注意原子守恒的灵活运用,题目难度不大.

练习册系列答案
相关题目
18.平衡常数的大小可以表示反应进行的程度,平衡常数越大,说明( )
| A. | 反应物平衡浓度较大 | B. | 反应越有利于往逆反应方向进行 | ||
| C. | 反应进行的越彻底 | D. | 生成物平衡浓度较小 |
19.怎样用化学方法除去下列物质中混有的少量杂质,写出除杂需加入的试剂以及发生反应的离子方程式.
学法题:归纳总结除杂试剂选择的方法所选试剂能够除去杂质,且不能引进新的杂质.
| 需加入的除杂试剂 | 发生反应的离子方程式 | |
| ①CO2气体中混有HCl杂质 | 饱和NaHCO3溶液 | H++HCO3-=H2O+CO2↑ |
| ②NaHCO3溶液中混有Na2CO3 | 足量CO2 | CO32-+H2O+CO2=HCO3- |
| ③FeCl2溶液中混有FeCl3杂质 | 铁粉 | Fe+2Fe3+=3Fe2+ |
| ④Fe2O3固体中混有Al2O3杂质 | NaOH溶液 | Al2O3+2OH-=AlO2-+2H2O |
16.将1mol一氧化碳和1mol水蒸气放入一固定容积的密闭容器中,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),在一定温度下,反应达到平衡后,得到0.6mol二氧化碳,再加入2mol水蒸气并在相同条件下达到新平衡后,下列叙述正确的是( )
| A. | 一氧化碳的转化率提高,水蒸气的转化率降低 | |
| B. | 反应物的转化率都提高 | |
| C. | 平衡向正反应方向移动,达到新的平衡时二氧化碳的体积分数增大 | |
| D. | 平衡向正反应方向移动,二氧化碳的物质的量将大于1 mol但小于2 mol |
3.如图为三种常见弱酸的电离平衡常数:则等物质的量浓度①CH3COONa溶液②Na2CO3溶液③NaHCO3溶液④NaClO溶液的pH由大到小的顺序正确的是( )
| 弱酸 | 电离常数 |
| CH3COOH | K=1.75×10-5 |
| H2CO3 | K1=4.4×10-7 k2=4.7×10-11 |
| HClO | K=3.2×10-8 |
| A. | ②>④>③>① | B. | ①>③>④>② | C. | ③>②>④>① | D. | ③>④>②>① |
13.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1L1mol/L的碳酸钠溶液中含CO32-NA个 | |
| B. | 标准状况下,11.2L甲醇与足量钠反应,可生成标准状况下氢气5.6L | |
| C. | H2O2和H2O的混合物1mol中,含阴离子个数为NA | |
| D. | 标准状况下,22.4LCl2与足量铁充分反应,电子转移数为2NA |
16.乙苯催化脱氢制苯乙烯反应:

(1)已知:
计算上述反应的△H=+124kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的压强平衡常数Kp=$\frac{{a}^{2}}{(1-{a}^{2})}P$(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
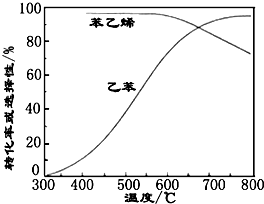
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦
合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO,据此可推知新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.

(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的压强平衡常数Kp=$\frac{{a}^{2}}{(1-{a}^{2})}P$(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦
合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO,据此可推知新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
17.已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )

| A. | 反应过程中的氧化产物均为SO3 | |
| B. | a点时消耗NaHSO3的物质的量为1.0 mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 当溶液中I?与I2的物质的量之比为1:1时,加入的NaIO3为1.2 mol |