题目内容
6. 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),已知3种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
(4)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
分析 (1)由电离能可知,A可失去3个电子,B可失去2个电子,则A为Al,B为Mg;
(2)离子晶体的晶格能越大,熔点越高;根据MgO晶胞的结构,可以确定一个Mg2+周围和它最邻近且等距离的Mg2+有数目;
(3)根据离子的最外层电子数判断;
(4)根据图片分析微粒间的作用力,然后判断含有的化学键类型.
解答 解:(1)由电离能可知,A可失去3个电子,最高化合价为+3价,B可失去2个电子,最高化合价为+2价,则A为Al,B为Mg,同周期元素从左到右元素的电负性逐渐增强,则电负性A>B,
故答案为:+3;>;
(2)KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似,TiN中离子都带3个单位电荷,MgO、CaO中离子都带2个单位电荷,KCl中离子都带1个单位电荷,离子半径Cl-<O2-<N3-,Mg2+<Ca2+<K+,高价化合物的晶格能远大于低价离子化合物的晶格,晶格能TiN>MgO>CaO>KCl,故熔点TiN>MgO>CaO>KCl;
在MgO晶胞中Mg2+周围有六个O2-,O2-周围有六个Mg2+,根据晶胞的结构可以看出,如果以体心上一个Mg2+为究对象,和它最邻近且等距离的Mg2+分布在晶胞每个棱边中点上,共有12个,故答案为:TiN>MgO>CaO>KCl;12;
(3)V2O5中V的最外层电子全部失去或成键,CrO2中Cr失去4个电子,离子的最外层电子为2,未成对,离子含未成对电子越多,则磁性越大,则适合作录音带磁粉原料的是CrO2,
故答案为:CrO2;
(4)该配合物中存在的化学键有:非金属元素之间的共价键,镍元素与氮元素之间的配位键,氧原子和氢原子之间的氢键,不存在金属键和离子键,故选A、C,
故答案为:AC.
点评 本题考查了配合物的成键情况、元素电离能、电负性的应用等知识,题目难度中等,明确配合物的成键情况为解答关键,注意掌握电负性、电离能的概念及影响因素,试题培养了学生的灵活应用能力.


(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的压强平衡常数Kp=$\frac{{a}^{2}}{(1-{a}^{2})}P$(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
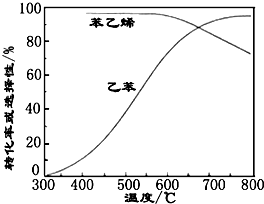
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦
合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO,据此可推知新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.

| A. | 反应过程中的氧化产物均为SO3 | |
| B. | a点时消耗NaHSO3的物质的量为1.0 mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 当溶液中I?与I2的物质的量之比为1:1时,加入的NaIO3为1.2 mol |
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO>HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
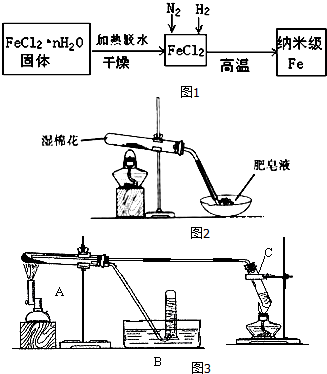
(1)生成纳米级Fe的化学方程式为FeCl2+H2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl.
(2)纳米级Fe粉在空气中易自燃成黑色固体,但是生活中的铁丝或铁粉在空气中加热也不能燃烧,其原因是纳米级Fe粉与气体接触面大,反应速率快.
(3)FeCl2•nH2O固体加热脱水通常要通入干燥的HCl气流,理由是HCl抑制FeCl2水解,且通入的HCl气体可带走水蒸气.
Ⅱ.查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同:温度低于570℃时生成FeO,高于570℃时生成Fe3O4.
甲同学用如图2所示装置进行纳米级Fe粉与水蒸气的实验:
(4)该装置中纳米级Fe粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeO+H2;
乙同学用如图3所示装置进行纳米级Fe粉与水蒸气的反应并验证产物:
(5)装置C的作用是制取水蒸气.
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了如表实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
(7)丁同学称取5.60gFe粉,用乙的装置反应一段时候后,停止加热.将试管内的固体物质在干燥
器中冷却后,称得质量为6.88g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3
的0.08mol.丁同学实验的固体产物为Fe3O4.
| A. | 21.2g | B. | 21.6g | C. | 22.0g | D. | 22.4g |
| A. | 5% | B. | 25% | C. | 17% | D. | 33% |
| A. | 在熔融状态或溶于水能导电的物质叫电解质 | |
| B. | 电解质在通电时发生电离 | |
| C. | 熔融的KOH导电,所以KOH是电解质 | |
| D. | NaCl晶体不导电,所以NaCl不是电解质 |
| A. | MgO | B. | AlCl3 | C. | KAlO2 | D. | NaHCO3 |