题目内容
1.实验室需要0.1mol•L-1的NaOH溶液450mL,根据配制情况回答下列问题:(1)实验室中除了托盘天平、烧杯、钥匙外还需要的其它仪器有玻璃棒、500mL容量瓶、胶头滴管.
(2)根据计算得知,所需要的NaOH的质量为2.0g.
(3)下列操作使所配溶液浓度偏大的有C(填字母,下同).
A.容量瓶未干燥就用来配制溶液
B.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
(4)如图是该学生在实验室配制该NaOH溶液得过程示意图,据此回答下列问题:
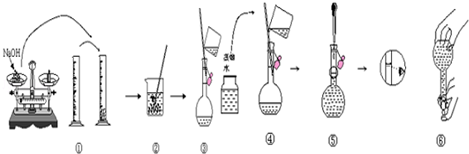
观察配制NaOH溶液的过程示意图,指出其中有错误的是①④⑤(填操作序号).
(5)用98%,1.84g/cm的浓硫酸配制250ml,2.0mol/L的稀硫酸需要此浓硫酸的体积是27.2mL.
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择合适的仪器;
(2)根据物质的量浓度公式计算NaOH的物质的量,进而求出其质量;
(3)依据C=$\frac{n}{V}$进行误差分析;
(4)根据溶液的配置步骤,找出错误;
(5)依据稀释前后溶质的物质的量不变,计算需要浓硫酸的体积.
解答 解:(1)配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、500mL容量瓶、胶头滴管;
故答案为:玻璃棒、500mL容量瓶、胶头滴管;
(2)配制0.1mol•L-1 NaOH溶液500mL,需要氢氧化钠质量=0.1mol•L-1×0.5L×40g/mol=2.0g;
故答案为:2.0;
(3)A.容量瓶未干燥就用来配制溶液,不会产生误差,故A错误;
B.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,n减小,c减小,故B错误;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,V减小,c增大;故C正确;
D.往容量瓶转移时有少量液体溅出,n减小,c减小,故D错误;
E.未洗涤溶解NaOH的烧杯,n减小,c减小,故E错误;
F.若定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏小;故F错误;
故答案为:C;
(4)称量NaOH,应该用小烧杯,①错误;没有洗涤玻璃棒,④错误;定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏小,⑤错误;
故答案为:①④⑤;
(5)设需要浓硫酸的体积为V,依据稀释前后溶质的质量不变得:V×98%×1.84g/cm=0.25L×2.0mol/L×98g/mol,
解得:V=27.2mL;
故答案为:27.2mL.
点评 本题主要考查一定物质的量浓度溶液的配制与稀释,熟悉配制过程是解题关键,注意容量瓶、量筒规格的选取方法为易错点,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
12.下列说法中正确的是( )
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 吸热反应只有在加热的条件下才能进行 | |
| C. | 放热反应可能需要在加热的条件下才能进行 | |
| D. | 化学反应中的能量变化都只以热能的形式表现出来 |
13.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1L1mol/L的碳酸钠溶液中含CO32-NA个 | |
| B. | 标准状况下,11.2L甲醇与足量钠反应,可生成标准状况下氢气5.6L | |
| C. | H2O2和H2O的混合物1mol中,含阴离子个数为NA | |
| D. | 标准状况下,22.4LCl2与足量铁充分反应,电子转移数为2NA |
16.乙苯催化脱氢制苯乙烯反应:

(1)已知:
计算上述反应的△H=+124kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的压强平衡常数Kp=$\frac{{a}^{2}}{(1-{a}^{2})}P$(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
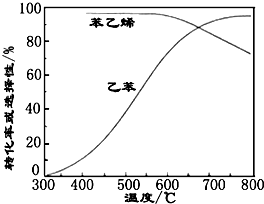
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦
合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO,据此可推知新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.

(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的压强平衡常数Kp=$\frac{{a}^{2}}{(1-{a}^{2})}P$(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦
合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO,据此可推知新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
11.过氧化钠可与CO2作用,反应方程式为2Na2O2+2CO2=2Na2CO3+O2.当0.2mol Na2O2完全作用后,Na2CO3的质量为( )
| A. | 21.2g | B. | 21.6g | C. | 22.0g | D. | 22.4g |
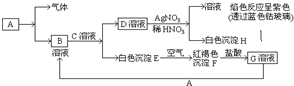 已知有以下物质相互转化,已知,A是世界上用量最大的金属单质,试回答:(1)写出E的化学式Fe(OH)2F的化学式Fe(OH)3;
已知有以下物质相互转化,已知,A是世界上用量最大的金属单质,试回答:(1)写出E的化学式Fe(OH)2F的化学式Fe(OH)3;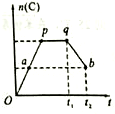 在一定条件,可逆反应:mA+nB?pC达到平衡状态.
在一定条件,可逆反应:mA+nB?pC达到平衡状态.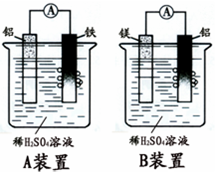 有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,
有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,