题目内容
2.设NA表示阿伏加徳罗常数的值.下列说法中不正确的是( )| A. | 0.1mol-NH2(氨基)中所含有的电子数为0.9NA | |
| B. | lmol D218O所含的中子数为12NA | |
| C. | 14 g聚乙烯与聚丙烯的混合物中含H原子的数目为2NA | |
| D. | 一定条件下,0.2 mol SO2与足量O2充分反应,生成的SO3分子数为0.2NA |
分析 A、-NH2(氨基)中含9个电子;
B、D218O中含12个中子;
C、聚乙烯和聚丙烯的最简式均为CH2;
D、二氧化硫和氧气的反应为可逆反应.
解答 解:A、-NH2(氨基)中含9个电子,故0.1mol氨基中含0.9NA个电子,故A正确;
B、D218O中含12个中子,故1mol此重水中含12NA个中子,故B正确;
C、聚乙烯和聚丙烯的最简式均为CH2,故14g聚乙烯和聚丙烯的混合物中含有的CH2的物质的量为1mol,故含2molH原子即2NA个,故C正确;
D、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故生成的三氧化硫分子个数小于0.2NA个,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
13.丙烯酸可与水反应生成乳酸,化学方程式如下,下列说法正确的是( )
CH2=CH-COOH+H2O$\stackrel{一定条件}{→}$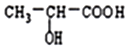
CH2=CH-COOH+H2O$\stackrel{一定条件}{→}$

| A. | 该反应为加成反应,没有副产物生成 | |
| B. | 可用Br2/CCl4溶液鉴别丙烯酸和乳酸 | |
| C. | 丙烯酸与乳酸都属于有机酸,两者不发生反应 | |
| D. | 1mol乳酸分别与足量Na、NaOH、NaHCO3反应,消耗三者物质的量之比为2:2:1 |
10. 工业上常用铁碳混合物处理含Cu2+废水获得金属铜.当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如图所示.下列推论不合理的是( )
工业上常用铁碳混合物处理含Cu2+废水获得金属铜.当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如图所示.下列推论不合理的是( )
 工业上常用铁碳混合物处理含Cu2+废水获得金属铜.当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如图所示.下列推论不合理的是( )
工业上常用铁碳混合物处理含Cu2+废水获得金属铜.当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如图所示.下列推论不合理的是( )| A. | 活性炭对Cu2+具有一定的吸附作用 | |
| B. | 铁屑和活性炭会在溶液中形成微电池,铁为负极 | |
| C. | 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率 | |
| D. | 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+═Fe2++Cu |
7.向盐酸中加入浓硫酸时,会有白雾产生.下列叙述不属于导致产生该现象的原因是( )
| A. | 浓硫酸有吸水性 | |
| B. | 盐酸有挥发性 | |
| C. | 气态溶质的溶解度随温度开高而降低 | |
| D. | 浓硫酸有脱水性 |
14.在含有大量H+、Ca2+、Cl-溶液中,还可以大量共存的离子是( )
| A. | OH- | B. | CO32- | C. | Ag+ | D. | Mg2+ |
13.25℃时,下列关系式正确的是( )
| A. | pH=2的CH3COOH 溶液与pH=12的Na0H溶液等体积混合:c(Na+)=c(CH3COO-)>c(CH3COOH) | |
| B. | 盐酸与FeCl3的混合溶液pH=2,稀释10倍后:pH<3 | |
| C. | pH相同的①NH4HSO4、②NH4Cl、③(NH4)2SO4三种溶液的c(NH4+):③>①>② | |
| D. | pH=3的H2C2O4溶液:c(H+)=c(HC2O4-)+c(OH-)=1×10-3mol/L |
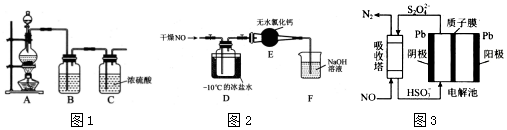
 MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体.
MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体. .
.