题目内容
7.元素A的单质能与H2化合生成HxA,在标准状况下8.5gHxA气体的体积是5.6L.含5.1g的HxA的溶液与200ml0.75mol/l的CuCl2溶液正好发生复分解反应,并生成黑色沉淀和一种强酸,则:(1)A 元素的相对原子质量32,若A 的质子数等于中子数,则A是S元素(填名称).
(2)A的最高价氧化物是SO3(填化学式).这一氧化物在室温下呈液态,将其熔化需要克服分子间作用力.
(3)HxA与CuCl2溶液反应的离子方程式H2S+Cu2+=CuS↓+2H+.
(4)A的单质在常温下是固体,在常温常压下0.25mol该单质完全燃烧放出QkJ的热量.写出该反应的热化学方程式:S(s)+O2(g)=SO2(g)△H=-4QkJ/mol.
分析 在标准状况下8.5g HxA气体的体积是5.6L,其物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故HxA的相对分子质量为$\frac{8.5}{0.25}$=34,含5.1g HxA的物质的量为$\frac{5.1g}{34g/mol}$=0.15mol,CuCl2的物质的量为0.2L×0.75mol/L=0.15mol,二者正好完全反应,生成黑色沉淀,则HxA中A表现-2价,故x=2,则A的相对原子质量,34-2=32,若A的质子数等于中子数,可推知A为S元素,据此解答.
解答 解:(1)在标准状况下8.5g HxA气体的体积是5.6L,其物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故HxA的相对分子质量为$\frac{8.5}{0.25}$=34,含5.1g HxA的物质的量为$\frac{5.1g}{34g/mol}$=0.15mol,CuCl2的物质的量为0.2L×0.75mol/L=0.15mol,二者正好完全反应,生成黑色沉淀,则HxA中A表现-2价,故x=2,则A的相对原子质量,34-2=32,若A的质子数等于中子数,可推知A为S元素,
故答案为:32;S;
(2)硫元素的最高价氧化物是SO3,室温下呈液态,分子间作用力影响物质的物理性质即熔沸点,
故答案为:SO3;液; 分子间作用力;
(3)HxA与CuCl2溶液反应的离子方程式为:H2S+Cu2+=CuS↓+2H+,故答案为:H2S+Cu2+=CuS↓+2H+;
(4)0.25mol该单质完全燃烧放出QkJ,故1mol该单质完全燃烧放出4QkJ,故热化学方程式为S(s)+O2(g)=SO2(g)△H=-4QkJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-4QkJ/mol.
点评 本题考查元素化合物推断,属于计算型推断,难度不大,注意三氧化硫的熔沸点.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案| A. | OH- | B. | CO32- | C. | Ag+ | D. | Mg2+ |
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 4 | 10 | 1 | 25 |
| 反应后的质量/g | 未测定 | 21 | 10 | 9 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
| 选项 | A | B | C | D |
| 名称 | 250mL容量瓶 | 分液漏斗 | 酸式滴定管 | 冷凝管 |
| 图形 |  |  |  | 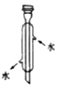 |
| 操作 | 定容时仰视刻度, 则配得的溶液浓 度偏小 | 用酒精萃取水中 碘从上倒出 | 可用于量取 Na2CO3溶液 | 蒸馏实验中将 蒸气冷凝为液体 |
| A. | A | B. | B | C. | C | D. | D |
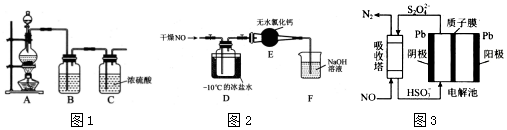
 MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体.
MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体. .
.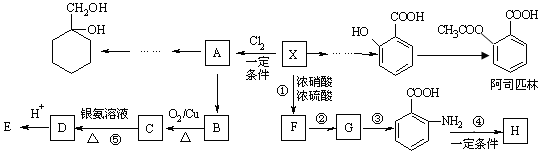

 ,反应①~⑤中属于取代反应的有①.
,反应①~⑤中属于取代反应的有①. .
.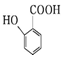 有多种同分异构体,请写出符合下列条件的同分异构体的结构简式
有多种同分异构体,请写出符合下列条件的同分异构体的结构简式 (或
(或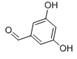 )(任写一种)
)(任写一种)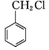 和其他无机试剂合成
和其他无机试剂合成 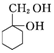 最合理的方案.
最合理的方案.