题目内容
20.已知:Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s);△H=234.1KJ/mol
C(s)+O2(g)═CO2(g);△H=-393.5KJ/mol
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H是( )
| A. | -1648.8KJ/mol | B. | -824.4KJ/mol | C. | +1648.8KJ/mol | D. | -744.7KJ/mol |
分析 根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减,据此判断.
解答 解:①Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s);△H=234.1KJ/mol
②C(s)+O2(g)═CO2(g);△H=-393.5KJ/mol
由盖斯定律②×3-①×2得:4Fe(s)+3O2(g)═2Fe2O3(s)△H=(-393.5KJ/mol)×3-(234.1KJ/mol×2)=-1648.7KJ/mol,
故选A.
点评 本题考查盖斯定律的利用,题目难度不大,明确已知反应与目标热化学方程式的关系是关键,注意基础知识的掌握与理解.

练习册系列答案
相关题目
10.在某温度时,水的离子积为1×10-12 mol2•L-2,若该温度下某溶液中H+浓度为1×10-7 mol•L-1,则该溶液( )①呈碱性 ②呈酸性 ③[H+]=100[OH-]④[OH-]=100[H+]⑤呈中性.
| A. | ①④ | B. | ② | C. | ②③ | D. | ⑤ |
11.相同温度下,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HM | HN | HR |
| 电离常数 K | 9×10-7 | 9×10-6 | 10-2 |
| A. | 三种酸的强弱关系:HM>HN>HR | |
| B. | 反应 HR+N-═HN+R-能够发生 | |
| C. | 相同温度下,0.1 mol/L 的 HM、HN、HR 溶液,HM 溶液 pH 最大 | |
| D. | 相同温度下,1 mol/L HM 溶液的电离常数大于 0.1 mol/L HM |
8.下列物质的水溶液中存在溶质分子的是( )
| A. | HCl | B. | NaHCO3 | C. | 蔗糖 | D. | Na2CO3 |
15.下列化学用语正确的是( )
| A. | CH2CH2--乙烯的结构简式 | B. | C2H6--乙烷的结构简式 | ||
| C. |  -甲基的电子式 -甲基的电子式 | D. |  --苯的分子式 --苯的分子式 |
5.下列有关化学用语使用正确的是( )
| A. | 硫离子的结构示意 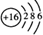 | B. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | ||
| C. | 明矾的化学式:KAlSO4•12H2O | D. | CO2的电子式: |
12.如表表示元素周期表的一部分,回答下列有关问题(要求用化学用语):
(1)写出下列元素符号:dMg、iAr.
(2)k原子的电子层数为4,f原子最外层电子数为4.
(3)这11种元素中,单质的化学性质最稳定的是Ar.
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的是Al(OH)3(写化学式);写出它们两两反应的化学方程式:HClO4+KOH=KClO4+H2O、Al(OH)3+3HClO4=Al(ClO4)3+3H2O、Al(OH)3+KOH=KAlO2+2H2O.
(5)证明c、d原子失电子能力强弱的实验方法是Na与冷水反应生成氢气比Mg更剧烈;证明g、h原子得电子能力强弱的方法(用离子方程式表示)是H2S+Cl2=2H++S↓+2Cl-.
| 族 周 期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i | |
| 4 | j | k |
(2)k原子的电子层数为4,f原子最外层电子数为4.
(3)这11种元素中,单质的化学性质最稳定的是Ar.
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的是Al(OH)3(写化学式);写出它们两两反应的化学方程式:HClO4+KOH=KClO4+H2O、Al(OH)3+3HClO4=Al(ClO4)3+3H2O、Al(OH)3+KOH=KAlO2+2H2O.
(5)证明c、d原子失电子能力强弱的实验方法是Na与冷水反应生成氢气比Mg更剧烈;证明g、h原子得电子能力强弱的方法(用离子方程式表示)是H2S+Cl2=2H++S↓+2Cl-.
9.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加入过量氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | [Cu(NH3)4]2+中,存在的化学键有离子键、极性共价键和配位键 | |
| D. | 沉淀溶解后,生成深蓝色的配合物SO42- |
10.下列物质不计入“空气污染指数”项目的是( )
| A. | 二氧化硫 | B. | 二氧化碳 | C. | 二氧化氮 | D. | 可吸入颗粒 |