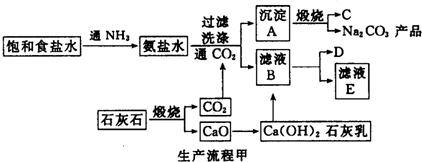
题目内容
8.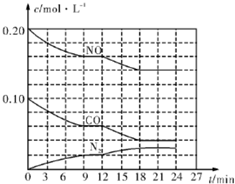 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.(1)C0在0〜9min内的平均反应速率w(C0)=4.4×10-3mol•L-1•min-1(保留两位有效数字);第12min时改变的反应条件可能为C.
A.升高温度 B.减小压强C.降低温度 D.加催化剂
(2)该反应在第24min时已达到平衡状态,此时C02的体积分数为22.2% (数值保留至小数点后一位),化学平衡常数K=3.4 (数值保留至小数点后一位).
分析 (1)根据v=$\frac{△c}{△t}$计算v(CO);12min时改变条件瞬间各组分浓度不变,而氮气浓度增大,NO、CO浓度减小,平衡正向移动,结合平衡移动原理分析解答;
(2)由(1)中可知12min时为改变温度,重新到达平衡时NO为0.14mol/L、CO为0.04mol/L、氮气为0.03mol/L,由方程式可知二氧化碳为0.06mol/L,二氧化碳条件分数=$\frac{平衡时二氧化碳浓度}{混合气体总浓度}$×100%,根据K=$\frac{c(N{\;}_{2})×c{\;}^{2}(CO{\;}_{2})}{c{\;}^{2}(NO)×c{\;}^{2}(CO)}$计算平衡常数.
解答 解:(1)0-9min内CO浓度变化为(0.1-0.06)mol/L=0.04mol/L,则v(CO)=$\frac{△c}{△t}$=$\frac{0.04mol/L}{9min}$=4.4×10-3L-1•min-1,
12min时改变条件瞬间各组分浓度不变,而氮气浓度增大,NO、CO浓度减小,平衡正向移动,正反应为放热反应,应是降低温度,
故答案为:4.4×10-3;C;
(2)由(1)中可知12min时为改变温度,重新到达平衡时NO为0.14mol/L、CO为0.04mol/L、氮气为0.03mol/L,由方程式可知二氧化碳为0.06mol/L,二氧化碳条件分数=$\frac{0.06}{0.14+0.04+0.03+0.06}$×100%=22.2%,平衡常数K=$\frac{c(N{\;}_{2})×c{\;}^{2}(CO{\;}_{2})}{c{\;}^{2}(NO)×c{\;}^{2}(CO)}$=$\frac{0.03×0.06{\;}^{2}}{0.14{\;}^{2}×0.04{\;}^{2}}$=3.4,
故答案为:22.2%;3.4.
点评 本题考查化学平衡计算与影响因素、反应速率、平衡常数应用计算等,需学生具备扎实的基础,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 蒸馏操作时,应将温度计插入蒸馏烧瓶内混合溶液中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| A. | ②④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A. | 由溶度积常数不能判断相应物质的溶解性大小 | |
| B. | 将等体积的4×10-3 mol/L的AgNO3溶液和4×10-3mol/L K2CrO4溶液混合,有Ag2CrO4沉淀产生 | |
| C. | 向AgCl的悬浊液中滴加饱和NaBr溶液不能得到黄色AgBr | |
| D. | 向100 mL 0.02mol/L的NaSO4溶液中加入100mL0.02mol/L的AgNO3溶液,有白色沉淀生成 |
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 其他条件不变,使用不同催化剂,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度可提高SO2的转化率 | |
| D. | 平衡时,其他条件不变,分离出硫,正反应速率加快 |
| A. | 将容器体积变为原来一半 | B. | 压强变为原来一半 | ||
| C. | 加入2n molCO,2n molH2O | D. | 加入2n molCO2和2n molH2 |